
- •Вищий державний навчальний заклад України
- •Медичний коледж
- •1.Науково-методичне обґрунтування теми:
- •2.Навчальні цілі лекції:
- •3.Цілі розвитку особистості майбутнього фахівця.
- •4.Міждисциплінарна інтеграція.
- •5. План та організаційна структура лекції.
- •6. Зміст лекційного матеріалу.
- •7.Матеріали активізації студентів під час лекції.
- •8.Матеріали для самопідготовки студентів.
- •9. Використана література для викладача.
6. Зміст лекційного матеріалу.
Розчини для ін’єкцій готують у відповідності з вимогами ДФУ, наказів МОЗ та технологічних інструкцій.
До ін'єкційних форм ДФУ, висуває наступні вимоги:
· відсутність механічних домішок,
· стерильність,
· стабільність,
· апірогенність,
· до окремих розчинів - ізотонічність, що вказується у відповідних нормативних документах чи рецептах.
· Ін'єкційні розчини можуть бути ізогідричними та ізоіонічними згідно з вимогами власних статей.
Для реалізації зазначених вимог необхідне дотримання особливих умов виготовлення ін'єкційних лікарських форм. Вони передбачають: вимоги до приміщення, виробничого устаткування, персоналу, лікарських і допоміжних речовин, розчинників, закупорювальних матеріалів, організації і проведення технологічних процесів (розчинення, стабілізація, фільтрування, стерилізація, упаковка, маркування).
Біофармація -теоретична основа технології ліків у фармації, що вивчає залежність терапевтичної дії лікарських препаратів від різних екзогенних і ендогенних перемінних факторів.
До основних напрямків біофармацевтичних досліджень відносяться:
-вивчення впливу фармацевтичних і біологічних факторів на
фармакодинаміку і фармакокінетику лікарських препаратів;
- вивчення біологічної приступності лікарської речовини і розробка методів її визначення;
- вивчення терапевтичної еквівалентності лікарських препаратів;
- розробка методів визначення лікарської речовини або його активного метаболіту в біологічних рідинах.
Вплив перемінних факторів на терапевтичну активність лікарських препаратів настільки істотний, що їхня фармакологічна дія може відрізнятися в кілька разів.
До перемінних факторів відносяться екзогенні й ендогенні. Найбільш велику групу складають перемінні фармацевтичні фактори, такі як фізичний стан лікарських речовин, проста хімічна модифікація, природа допоміжних речовин, вид лікарської форми і шлях введення, а також технологічні процеси, приводить до біологічної нееквівалентності лікарських препаратів - аналогів.
Не можна виключати і роль екзогенних факторів (пори року, час доби, погодні умови).
Біофармацевтичні дослідження мало актуальні при розробці ін'єкційних лікарських форм, тому що при їхньому введенні відсутня стадія вивільнення й абсорбції, оскільки лікарська речовина надходить безпосередньо в кров, а з нею - до потрібного органу. Виключення в даному випадку складають парентеральні лікарські форми, що мають пролонговану дію та, які забезпечують рівномірну або контрольовану подачу лікарських речовин у кровоток.
Удосконалювання традиційних лікарських форм, створення і виробництво сучасних ліків із контрольованим вивільненням і спрямованою доставкою лікарських речовин є серйозним досягненням технології ліків, що стало можливим тільки на основі комплексних хіміко-технологічних і біофармацевтичних експериментальних досліджень.
Найважливішою складовою технологічного процесу всіх ін'єкційних лікарських форм є організація роботи в асептичних умовах і стерилізація.
Технологічний процес приготування розчинів для ін’єкцій складається із наступних стадій:
Підготовчі роботи;
Приготування розчину (стабілізація, ізотонування за необхідності)
Фільтрування та фасування розчину.
Стерилізація розчину.
Контроль готової продукції.
Оформлення.
Підготовчі роботи (підготовка персоналу, підготовка асептичного блоку, організація роботи в асептичних умовах, підготовка посуду та допоміжних матеріалів, підготовка розчинників та препаратів) див. попередню лекцію.
Приготування розчину. Приготування розчинів для ін’єкцій може проводитися тільки в аптеках, що мають на це дозвіл, який видається уповноваженим органом.
Не дозволяється готувати розчини для ін’єкцій за відсутності методики їх повного хімічного аналізу, режиму стерилізації, даних про хімічну сумісність інгредієнтів, що входять та технології.
Персональна відповідальність за організацію роботи асептичних блоків та приготуванні розчинів для ін’єкцій покладається на завідуючих аптеками. Вони зобов’язані проводити щорічний інструктаж та перевірку знань працівників асептичних блоків щодо правил приготування розчинів для ін’єкцій, а також при прийомі чи переведенні їх на роботу в асептичному блоці. Особи, що не володіють технологією приготування лікарських форм для ін’єкцій, до роботи в асептичному блоці не допускаються.
У зв’язку із досить відповідальним способом застосування та великою небезпекою помилок, які можуть бути допущеними під час роботи, приготування ін’єкційних розчинів потребує строгої регламентації та неухильному дотриманні технології.
Не допускається одночасне приготування декількох ін’єкційних розчинів, що мають різні інгредієнти або одні і ті ж, але в різних концентраціях.
На робочому місці підчас приготування концентрованих розчинів не повинно бути штангласів із лікарськими речовинами, які не мають відношення до цих розчинів.
Приготування ін’єкційних розчинів проводиться масо-об’ємним методом, при якому лікарська речовина береться за масою, а розчинник до отримання певного об’єму розчину. Необхідність приготування розчинів масо-об’ємним методом пояснюється тим, що при введенні за допомогою шприца лікарський препарат дозується за об’ємом.
Технологічна стадія «Приготування розчину» включає три технологічні операції: підготування сировини (проведення розрахунків, відважування сировини та відмірювання розчинника), безпосередньо приготування розчину (розчинення речовин, якщо необхідно –додавання стабілізатора, отримання потрібного об’єму) та первинний аналіз.
Взяту за масою лікарську речовину вміщують до стерильної мірної колби, розчиняють у невеликій кількості розчинника, а потім доводять до певного об’єму. При відсутності мірного посуду, кількість розчинника, необхідного для приготування розчину, визначають розрахунковим способом, користуючись величиною щільності розчину даної концентрації або коефіцієнтом збільшення об’єму.
Об’єм, що займає стабілізатор входить в загальний об’єм розчину, тому він додається одночасно із лікарськими речовинами.
При укрупненому приготуванні розчинів для ін’єкцій потребуються ємності об’ємом від 10 л та більше. В крупних міжлікарняних та лікарняних аптеках розчинення лікарських препаратів проводиться в скляних 20-тилітрових реакторах, обладнаних електропідігрівом та електромішалками. В середніх за потужністю виробництва міжлікарняних аптеках процес перемішування рідини механізований за допомогою мішалок різного виду.
Негайно після приготування розчину проводять опитний контроль. Далі розчин для ін’єкцій піддають повному первинному хімічному контролю, який полягає у визначенні ідентичності (якісний аналіз) та кількісного вмісту (кількісний аналіз) діючих речовин та стабілізатору.
Результати повного хімічного контролю розчинів для ін’єкцій реєструються
в журналі за встановленою формою.
У випадку задовільного результату приступають до фільтрування та фасування.
Фільтрування та фасування розчинів для ін’єкцій.
Однією із вимог, що пред’являються до лікарських форм для ін’єкцій, є відсутність механічних домішок. Ін’єкційні розчини не повинні містити видимих неозброєним оком часток. Наявність часточок є недопустимим.
Звільнення ін’єкційних розчинів від механічних домішок здійснюється шляхом фільтрування. Ступінь очистки дисперсних систем наряду із іншими факторами обумовлюється властивістю завислих часток «прилипати» до фільтруючого шару. При цьому частки затримуються у тому випадку, якщо сили їх адгезії до фільтруючого матеріалу більші сил відриву, що виникають при гідродинамічній дії потоку.
В аптечній практиці поширені два способи фільтрування: самотоком та за допомогою вакууму.
Основним методом фільтрування розчинів для ін’єкцій при крупно-серійному приготуванні в аптеках вакуумний, який полягає в тому, що в приймальному посуді створюється розрідження. Під дією різниці тиску рідина, проходячи через фільтри, заповнює приймальну посудину.
Чистота розчину залежить від вибору фільтра. Тому вибір оптимального фільтра – відповідальний момент в технології ліків.
Для фільтрування ін’єкційних розчинів використовують беззольні фільтри із фільтрувального паперу ФО, що затримує дрібнодисперсні осади. Необеззолений фільтрувальний папір містить солі кальцію, магнію, заліза та при фільтруванні через такий папір виникають зміни властивостей деяких розчинів. Широко застосовуються скляні фільтри №3 та №4.
Сучасним способом очистки ін’єкційних розчинів є мембранна мікрофільтрація – процес мембранного розділення мікрозависей під тиском та дозволяє отримати розчини. Вільні від механічних часток, видимих та невидимих при візуальному контролі, включаючи мікроорганізми.
Так, для фільтрування під вакуумом чи тиском ін’єкційних розчинів запропонований поліпропілен. Використовується у вигляді пластин в різних фільтрах дискової конструкції, різних прес фільтрах у фільтротримачах типу «Міліпор».
Фільтрування розчинів поєднують із одночасним їх розливом у підготовлені стерильні флакони. Відхилення від об’єму, вказаного на етикетці, допускається в межах ±10% для флаконів місткістю до 50 мл та ± 5% для посуду, місткістю більше 50 мл.
Для упаковки ін’єкційних лікарських форм використовується два види тари: ампули та флакони із скла, поліетилену чи іншого матеріалу, який не змінює властивостей лікарських речовин.
Ампули є заводською формою упаковки, з аптек же лікарські форми для ін’єкцій відпускаються в широкогорлих стандартних градуйованих флаконах різної ємності, із стандартною каучуковою пробкою та, яку закріплюють обтисненим алюмінієвим ковпачком.
Профільтровані розчини для ін’єкцій після розливу їх і флакони перевіряють на відсутність механічних включень.
Для цього використовується пристрій УК-2. Розчини переглядаються неозброєним оком. Відстань від очей до флакона повинна становити в межах 25 см. В розчинах для ін’єкцій не повинні виявлятися механічні включення.
При виявленні механічних включень розчини повторно фільтрують, знову проглядають, закупорюють (перевіряють герметичність), маркують та стерилізують.
Стерилізація розчинів для ін’єкцій повинна здійснюватися не пізніше трьох годин від початку приготування під контролем спеціально виділеного спеціаліста. Реєстрація параметрів стерилізації проводиться у відповідному журналі реєстрації стерилізації ін’єкційних та інфузійних лікарських засобів за формою згідно наказу МОЗ №812.
Контроль готової продукції.
Після стерилізації проводять вторинний контроль на відсутність механічних включень, якісний та кількісний аналіз. Для аналізу відбирають один флакон розчину від кожної серії (за одну серію розчину вважають продукцію, отриману в одній ємності від однієї загрузки лікарської речовини). Одночасно проводиться перевірка якості закупорки флаконів (алюмінієвий ковпачок не повинен прокручуватися при повороті вручну) та об’єм наповнення флаконів (± 5%).. Контроль ін’єкційних та внутрішньовенних інфузійних лікарських засобів, води для ін’єкцій на відсутність бактеріальних ендотоксинів або пірогенів здійснюється вибірково один раз на місяць в атестованих лабораторіях.
Контроль на стерильність ін’єкційних, внутрішньовенних інфузійних лікарських засобів, офтальмологічних та інших лікарських засобів, до яких ставляться вимоги щодо їх стерильності, здійснюється щомісяця вибірково в лабораторіях, атестованих згідно з установленим порядком.
Таким чином, контроль якості розчинів для ін’єкцій повинен охоплювати всі стадії їх приготування. Результати постадійного контролю приготування розчинів для ін’єкцій реєструють в спеціальному журналі за встановленою формою.
Розчини для ін’єкцій вважаються незадовільно приготовленими при невідповідності їх фізико-хімічним показникам, при вмісті в них видимих механічних включень, нестерильності та пірогенності, порішенні фіксованості закупорки, недостатньому заповненні об'єм’ флаконів.
Оформлення розчинів для ін’єкцій.
На всіх видах внутрішньоаптечних заготовок та лікарських засобах, до яких ставляться вимоги щодо стерильності, повинно додатково зазначатися: «Стерильно» (етикетка – на білому фоні синій шрифт) або: «Приготовлено асептично» (етикетка – на білому фоні синій шрифт) – для препаратів, які не підлягають стерилізації.
На етикетках внутрішньовенних інфузійних лікарських засобів додатково зазначаються значення осмоляльності (осмолярності) та іонний склад розчину.
Приклад приготування розчину для ін’єкцій.
Rp.: Solucionis Analgini 25% 50 ml
Sterilisa!
Da. Signa. По 1 мл внутрішньом’язово двічі на день.
Анальгін відноситься до речовин списку «Б». Його вища разова доза внутрішньом’язово становить 0,5, вища добова доза – 1,5.
В 1 мл розчину міститься 0,25 речовини, а в 2 мл – 0,5г речовини. Відповідно доза не завищена.
Коефіцієнт збільшення об’єму анальгіну складає 0,68 мл/г. Анальгіну необхідно взяти 12,5 г, води очищеної для ін’єкцій – 41,5 мл, тобто
50 мл – (12,5 * 0,68) .
Паспорт письмового контролю:
Дата № рецепту
Analgini 1.25
Aqua pro injectionibus 41,5 ml
Sterilis V = 50ml
Приготував
Перевірив
В асептичній кімнаті в стерильній підставці розчиняють 12,5 анальгінуу воді для ін’єкцій, розчин фільтрують через скляний стерильний фільтр в стерильний флакон відповідної ємності. Його закупорюють стерильною гумовою пробкою та обтискують металевим ковпачком. За допомогою УК-2 перевіряють розчин на предмет механічних включень. Далі флакон обв’язують пергаментним папером, на якому роблять напис простим олівцем про найменування та концентрацію розчину. Потім розчин стерилізують в автоклаві при температурі 121°С 8 хв.. Після стерилізації та охолодження розчин повторно перевіряють для виявлення механічних забруднень, на колірність. Потім розчин оформлюють до відпуску.
Термін зберігання розчину 1 місяць
СТАБІЛІЗАЦІЯ РОЗЧИНІВ ДЛЯ ІН’ЄКЦІЙ.
Під стабільністю розуміють властивість препаратів зберігати фізико-хімічні властивості та фармакологічну активність на протязі певного терміну зберігання, передбаченого вимогами нормативної документації.
Вивчення питань стабілізації - важливе технологічне завдання, оскільки 90% лікарських речовин вимагає застосування стабілізаторів або особливих умов приготування. Це пояснюється тим, що розчини лікарських речовин при термічній стерилізації зазнають різних змін. Причиною їх можуть бути реакції гідролізу, окислення-відновлення,, декарбоксилювання, полімеризації та ін.
Стабільність лікарських препаратів залежить від:
Температури зберігання;
Освітлення;
Складу навколишнього середовища;
Способу приготування;
Допоміжних речовин;
Виду лікарської форми (особливо агрегатного стану);
Упаковки.
Для підвищення стійкості лікарських форм для ін’єкцій використовують стабілізацію фізичними, хімічними та комплексними методами.
Основний принцип стабілізації препаратів передбачає максимальне усунення факторів, що сприяють зміні властивостей лікарських речовин.
Фізичні методи стабілізації.
В лікарських препаратах проходять наступні фізичні процеси:
Укрупнення часток дисперсної фази;
Розшарування;
Зміна консистенції;
Випарювання;
Сублімація.
Для попередження вказаних процесів використовують наступні методи стабілізації.
Кип’ятіння води із наступним швидким її охолодженням;
Насичення води для ін’єкцій діоксидом вуглецю або інертними газами;
Перекристалізація вихідних речовин;
Обробка розчинів адсорбентами.
Хімічні методи стабілізації.
В процес стерилізації та зберігання можливе розкладання речовин: можуть утворюватися осади, токсичні речовини, змінюється колір та властивості. При підвищенні температури на кожні 10°С швидкість хімічної реакції зростає в 2-4 рази, відповідно хімічні зміни в багато разів прискорюються при стерилізації.
Хімічна стабільність розчинів залежить від:
Якості розчинників та лікарських речовин
Класу та марки скла флаконів;
Наявністю кисню у воді та розчинах;
рН розчинів;
температури та часу стерилізації;
наявності іонів важких металів;
умов зберігання препаратів.
В лікарських препаратах протікають наступні хімічні процеси:
Гідроліз;
Омилення;
Реакція окислення-відновлення;
Декарбоксилювання;
Ізомеризація;
Рацемізація;
Полімеризація;
Фотохімічна деструкція.
Стабілізація хімічними методами здійснюється додаванням до розчину хімічних речовин (стабілізаторів або антиоксидантів); підбором відповідних систем розчинників; введенням речовин, які забезпечують значення рН середовища, при яких препарат є максимально стійким; переводом нерозчинної активної речовини в розчинні солі або комплексні сполуки.
Стабілізатори – речовини, що підвищують хімічну стійкість лікарських речовин в розчинах для ін’єкцій.
Речовини, що застосовуються в якості стабілізаторів повинні відповідати наступним вимогам:
Бути безпечними для хворого, як в чистому вигляді, так і в складі з компонентами лікарського препарату;
Дозволені фармакологічним комітетом до застосування в медичній практиці;
Виконувати функціональне призначення – забезпечувати стійкість лікарської речовини.
Хімічна чистота;
Доступність.
Вибір стабілізатора залежить від природи речовини та характеру хімічного процесу, що проходить в розчині.
Стабілізатори умовно поділяються на дві групи:
Речовини, що перешкоджають гідролізу солей та омиленню складних ефірів.
Антиокислювачі (антиоксиданти) – речовини, що перешкоджають окисленню.
Механізм дії стабілізаторів зводиться до
покращення розчинності лікарських речовин (солюбілізація),
створення певного значення рН середовища,
попередження окисно-відновлювальних процесів.
Гідролізом – називають реакції іонного обміну між різними речовинами.
СХЕМА ПРОЦЕСУ ГІДРОЛІЗУ
РА + НОН → НА + РОН
Де РА – речовина, яка гідролізується;
НА та РОН – продукти гідролізу.
Фактори, що впливають на ступінь гідролізу:
Хімічна природа солі;
Температура;
Концентрація солі.
Стабілізація солей, утворених сильними кислотами та слабкими основами.
До цього типу солей відносяться солі алкалоїдів, азотистих основ (новокаїн, дибазол, морфіну гідрохлорид). Водні розчини таких солей, як правило, можуть мати нейтральну або слабкокислу реакцію, внаслідок гідролізу, який протікає практично повністю.
СХЕМА ГІДРОЛІЗУ
РА + НОН↔ РОН + Н+ + А-, де
РА – речовина, що гідролізується;
РОН – основа, що слабкодисоціює.
Сіль РА дисоціює на іони Р+ та А- із утворенням основи, що слабкодисоціює та сильнодисоційованої кислоти. В результаті в розчині створюється висока концентрація іонів Н+ , що призводить до зниження рН.
Додавання до цих розчинів вільної кислоти, тобто надлишку іонів водню, пригнічує гідроліз, зсуваючи зрушення рівноваги вліво. Зменшення в розчині іонів водню в розчині, в результаті впливу лугу, що виділяється склом, зсуває рівновагу вправо, тобто посилює гідроліз. Нагрівання розчинів підвищує інтенсивність гідролізу солей та збільшує ступінь дисоціації, тому при наступній стерилізації та зберіганні рН розчинів підвищується. Для стабілізації розчинів таких солей в якості стабілізатора, що буде пригнічувати процес гідролізу рекомендується додавати кислоту хлористоводневу.
Кількість кислоти хлористоводневої, що необхідна для стабілізації розчину, залежить від властивостей препарату. Найбільш звична норма витрати стабілізатора – 10 мл 0,1 М розчину кислоти хлористоводневої на 1л.
Для приготування невеликих кількостей розчинів для забезпечення точного дозування доцільно готувати 0,01 М розчин стабілізатора за прописом:
0,42 мл розведеної (8,3%) кислоти хлористоводневої на 100мл розчину. Розчин розливають у невеликі флакони по 10 мл із нейтрального скла та стерилізують. У порівнянні із 0,1М розчином – 0,01М розчину додають у 10 разів більше. Термін зберігання його не більше 5 діб.
Об’єм стабілізатора входить до загального об’єму розчину.
Для стабілізації розчинів новокаїну необхідне додавання кислоти хлористоводневої до рН = 3,8 -4,5. Із збільшенням його концентрації збільшується кількість стабілізатора (розчини 0,25; 0,5; 1; 2%-ві потребують 3; 4; 9 та 12 мл 0,1 М розчину кислоти хлористоводневої на 1л розчину).
Для приготування стабільного розчину новокаїну (1-2%) на ізотонічному розчині натрію хлориду додають 5 мл 0,1 М р-ну на 1л.
Новокаїн іноді прописують в рецепті разом із розчином адреналіну гідрохлориду (1:1000). В цих випадках додають стабілізатор, що складається із 0,05 г саліцилової кислоти, 0,4 г натрію сульфіту та 0,2г натрію метабісульфіту. Розчин стерилізують на протязі 15 хвилин при 100°С.
 Розчини
солей сильних кислот та слабких основ
Розчини
солей сильних кислот та слабких основ
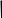 є
стабільними
у наступних випадках
є
стабільними
у наступних випадках





 Без
додавання При додаванні стабі-
При додаванні
Без
додавання При додаванні стабі-
При додаванні
Стабілізатора лізатора стабілізатора
та антиоксиданта
Розчини: Розчини: Розчини:
Дімедролу; Атропіну сульфату; апоморфіну
Папаверину г/хл; дібазолу; гідрохлориду;
Тримекаїну; дикаїну (0,1%;0,2%;0,3%) новокаїну (5%,10%)
Еметину г/хл; новокаїну (0,25%; 0,5%;
Ефедрину г/хл. 1%; 2%);
Скополаміну г/бр;
Спазмолітину;
Стріхнину нітрату.
Стабілізація розчинів солей, утворених слабкими кислотами та сильними основами.
До цієї групи відносяться: натрію нітрит, кофеїн-бензоат натрію, натрію тіосульфат, еуфілін та ін.
У водних розчинах ці речовини легко гідролізуються, дисоціюючи ан іони і розчин набуває лужної реакції. Дисоціюють на іони і молекули води. В результаті взаємодії іонів солі та води утворюється кислота, що слабкодисоціюється НА. Це спричинює зменшення в розчині вільних іонів водню та накопичення надлишку іонів ОН-, в результаті рН розчину збільшується.
СХЕМА ГІДРОЛІЗУ СОЛІ СЛАБКОЇ КИСЛОТИ ТА СИЛЬНОЇ ОСНОВИ
РА + НОН ↔ Р+ + ОН- +НА,
Де РА – речовина, що дисоціює4
НА – кислота, що слабкодисоціює.
Це призводить до утворення важкорозчинних сполуук, що дають в розчинах муть або осад, що є недопустимим для ін’єкційних розчинів.
Для стабілізації розчинів солей слабких кислота та сильних основ рекомендується додавати стабілізатори основного характеру – 0,1 М розчин натрію гідроксиду або натрію гідрокарбонату.
Для забезпечення сприятливих умов для стабілізації препаратів, що піддаються гідролізу, рН розчину доводять до критерію, який відповідає мінімальному розкладанню речовин, додаванням різних речовин або буферних систем. Оптимальне значення рН вказано в НТД або встановлюється дослідним шляхом.
Так, для стабілізації 1л 10 та 20% розчину кофеїн-бензоату натрію рекомендується додавати 4 мл 0,1М розчину натрію гідоксиду, а до 30% розчину тіосульфату натрію – натрію гідрокарбонат в кількості 20,0 г на 1л.
Еуфілін – це сіль, утворена слабкою кислотою та слабкою основою. Він легко розкладається в кислому середовищі, проте додавання розчину натрію гідроксиду теж призводить до розкладення еуфіліну. Тому для отримання стійких розчинів еуфіліну необхідно застосовувати препарат із вмістом етилендіаміну – 18-22%, тефіліну – 75 -82% та такий, що витримує додаткові випробування. Вода для ін’єкцій повинна бути вільною від вуглекислоти шляхом кип’ятіння або насичення азотом.
Стабілізація легкоокислювальних речовин.
До даної групи речовин відносяться: кислота аскорбінова, вікасол, натрію саліцилат, салюзид, стрептоцид розчинний, сульфацил-натрій, тіаміну хлорид, похідні фенотіазину, новокаїнамід та деякі інші лікарські речовини.
Причиною легкого окислення є вміст фенільної, карбонільної, етаноло-, аміно-груп, тобто груп із рухливим атомом водню.
Окислення лікарських речовин в процесі приготування ін’єкційних розчинів проходить в присутності кисню, що міститься у воді та над розчином. Процес окислення значно посилюється під впливом сенсибілізуючих факторів:
Світло;
Тепло;
Значення рН тощо.
Згідно теорії цепних реакцій, рухливий атом водню відривається від молекули та утворюється вільний радикал. Він реагує з киснем, утворюється пероксидний радикал. Пероксидний радикал реагує із іншими молекулами речовин, що окислюються, утворюється гідропероксиж та овий радикал. Гідропероксид розпадається із утворенням нових радикалів – цепна реакція.
СХЕМА ПРОЦЕСУ ОКИСЛЕННЯ.
RH→R.→RO2.→ROOH→R.,
Де RH – речовина, що окислюється;
R- - Алкільний радикал;
RO2 - Перекисний радикал;
ROOH -Гідроперекис.
Стабілізація розчинів легкоокислювальних речовин здійснюєтья шляхом:
Ведення антиоксидантів;
Введення комплексонів для зв’язування іонів важких металів;
Створення оптимальних меж рН;
Зменшення вмісту кисню в розчиннику та над розчином (насичення СО2 , заповнення в току інертного газу);
Використання світлонепроникної тари для зменшення ініціюючого впливу світла.
Характеристика антиоксидантів.
Для стабілізації розчинів речовин, що легкоокислюються, в фармацевтичній практиці застосовують допоміжні речовини, що перешкоджають окисленню – антиоксиданти.
Вимоги, які пред’являються до антиоксидантів.
Безпечність в дозах, що застосовуються, як самих антиоксидантів, так і продуктів їх метаболізму та інгредієнтів, які утворюються (відсутність подразнюючої та алергізуючої дії);
Ефективність при мінімальних концентраціях;
Добра розчинність в дисперсійному середовищі.
Класифікація антиоксидантів.


До прямих антиоксидантів відносяться сильні відновлювачі, що мають високу здатність до окислення, ніж лікарські речовини, що ними стабілізуються.
До прямих антиоксидантів належать:
Речовини, що перешкоджають утворенню активних радикалів із пероксидів (феноли, нафтоли, ароматичні аміни,амінофеноли);
Речовини, що руйнують гідропероксиди (сполуки, що містять атоми сірки, фосфору, азоту);
Речовини, які обривають ланцюг окислення по реакції із алкільними радикалами (хінони, нітросполуки, молекулярний йод).
До таких речовин належать ронгаліт, натрію сульфіт, натрію метабісульфіт, аскорбінова кислота, цистеїн, метіонін та ін.
Натрію сульфітом стабілізуються розчини стрептоциду розчинного 5 та 10% (2,0 на 1л розчину).
Натрію метабісульфіт додається од розчину натрію саліцилату 10% (1,0 на 1 л розчину), розчину кислоти аскорбінової 5% (2,0 на 1 л розчину).
Механізм стабілізації полягає в тому, що антиоксиданти легше окислюються, ніж діючі речовини, та кисень, розчинений в ін’єкційному розчині, витрачається на окислення стабілізатора, тим самим захищаючи препарат від окислення.
До непрямих антиоксидантів належать: речовини, які зв’язують катіони металів у сполуки, що практично не дисоціюють та, які потрапляють в розчини лікарських речовин як домішки із лікарських препаратів та являються каталізаторами окисних процесів.
Сюди належать:
Багатоосновні карбонові кислоти;
Оксикислоти (лимонна, саліцилова, виннокам’яна та ін.)
Етилендіамінтетраоцтова кислота (трилон Б); кальцієва сіль трилону Б (тетацин);
Унітіол;
Амінокислоти.
Непрямі антиоксиданти являються комплексоутворювачами.
Стабілізація комплексним методом.
Стабілізація розчинів для ін’єкцій іноді здійснюється введенням декількох стабілізаторів. Такий комплекс може бути представленим поєднання різних типів стабілізаторів: декількома прямими антиоксидантами; прямим та непрямим антиоксидантами; антиоксидантом та речовиною, що забезпечує рН середовища; антиоксидантом та консервантом ( антимікробна стабілізація).
Наприклад: декількома антиоксидантами стабілізуються розчини дипразину;
Антиоксидантом та регулятором рН середовища стабілізується озчин індигокарміну;
Розчин апоморфіну готується на розчиннику, що містить анальгін, цистеїн та 0,1 М розчин кислоти хлористоводневої.
Таким чином, для стабілізації сполук, що окислюються необхідно створити оптимальні значення рН розчинів, виключити вплив: кисню на лікарські речовини, каталізаторів в процесі приготування, стерилізації та зберігання лікарського препарату.
Приклади приготування розчинів, що потребують стабілізації.
Розчини речовин, утворених сильною кислотою та слабкою основою.
Rp.: Solutionis Dibasoli 1% 50 ml
Sterilisetur!
Da. Signa. По 2 мл 1 раз в день.
Дібазол належить до речовин списку Б. Вища разова доза при внутрішньом’язовому та внутрішньовенному введенні для 1% розчину становить 2 мл, добова доза становить 4 мл. Доза не завищена.
Дата № рецепту
Aqua pro injectionibus ad 50ml
Dibasoli 0.5
Solutionis acidi hydrochloride 0.1 M 0.5 ml
Sterilis V = 50ml
Приготував
Перевірив
Технологія та її обгрунтування.
В рецепті прописаний розчин речовини, важко розчинної у воді.
Ін’єкційні розчини дібазолу потребують стабілізації 0,1 М розчином гідрохлоридної кислоти.
В асептичних умовах, в стерильній мірній колбі на 50 мл в частині води для ін’єкцій розчиняють 0,5 дібазолу, додають 0,5 мл (із розрахунку 10 мл стабілізатора на 1л розчину) 0,1 М розчину хлористоводневої кислоти та доводять водою до мітки.
Приготовлений розчин фільтрують в склянку для відпуску ємністю 50 мл із нейтрального скла через скляний фільтр. Флакон закупорюють, обтискують алюмінієвим ковпачком та перевіряють на відсутність механічних включень. Далі флакон обв’язують пергаментним папером, на якому роблять напис простим олівцем про найменування та концентрацію розчину. Потім розчин стерилізують в автоклаві при температурі 121°С 8 хв.. Після стерилізації та охолодження розчин проводять вторинний контроль якості та оформляють до відпуску номером рецепту, етикетками «Для ін’єкцій», «Стерильно».
Термін зберігання розчину 1 місяць
Розчини речовин, утворених слабкою кислотою та сильною основою.
Rp.: Solutionis Coffeini –Natrii benzoatis 10% 50ml
Sterilisa!
Da. Signa. По 2мл внутрішньом’язово двічі на день.
Розчини кофеїну -бензоату натрію стабілізують 0,1 М розчином натрію гідроксиду в кількості 4 мл на 1 л розчину, незалежно від кофеїн бензоату натрію для створення рН 6,8 – 8,5.
Даний лікарський препарат – розчин сильнодіючої речовини – солі сильної основи та слабкої кислоти для ін’єкцій, потребуючий стабілізації.
В мірну колбу вміщують 10,0 кофеїн-бензоату натрію, розчиняють в частині води для ін’єкцій, додають 4 краплі 0,1 М розчину натрію гідроксиду та доводять водою для ін’єкцій до об’єму 50 мл.
Після якісного та кількісного аналізу розчин фільтрують у флакон для відпуску, перевіряють на наявність механічних забруднень. Герметично закупорюють під обкатку та стерилізують.
Проводять вторинний контроль якості та оформляють до відпуску номером рецепту, етикетками «Для ін’єкцій», «Стерильно».
Термін зберігання розчину 1 місяць .
Дата № рецепту
Coffeini-natrii benzoatis 5.0
Solutionis Natrii hydroxydi 0.1M gtts IV
(1мл -20 крап.)
Aquae pro injectionibus ad 50 ml
Sterilis V = 50 ml
Приготував
Перевірив
Приготування розчинів речовин, що легкоокислюються.
Rp.: Solutionis Acidi ascorbinici 5% 50 ml
Sterilisa!
Da. Signa По 1 мл 2 раза в день.
Розчин кислоти аскорбінової стабілізують введенням антиоксиданту натрію метабісульфіту із розрахунку 1г на 1л розчину або натрію сульфіту безводного із розрахунку 2г на 1л. Окрім цього, розчини кислоти аскорбінової надто кислі. З метою нейтралізації середовища до складу розчину вводиться натрію гідрокарбонат із розрахунку 2,38г на 1л. Розчин натрію аскорбінату, що утворюється має рН 6-7.
В асептичних умовах в мірній колбі розчиняють 2,5г кислоти аскорбінової; 1,19 натрію гідрокарбонату та 0,1с натрію сульфіту безводного в частині води для ін’єкцій. По закінченню виділяння бульбашок газу розчин доливають до 50 мл.
Після якісного та кількісного аналізу розчин фільтрують у флакон для відпуску, перевіряють на наявність механічних забруднень. Герметично закупорюють під обкатку та стерилізують.
Проводять вторинний контроль якості та оформляють до відпуску номером рецепту, етикетками «Для ін’єкцій», «Стерильно».
Термін зберігання розчину 1 місяць .
Дата № рецепта
Natrii sulfitis anhydrici 0,1
Acidi ascorbinici 2,5
Natrii hydrocarbonatis 1,19
Aquae pro injectionibus ad 50 ml
Sterilis V = 50 ml
Приготував
Перевірив
Приготування розчинів натрію гідрокарбонату
Розчини натрію гідрокарбонату в концентрації 3, 4, 5 та 7% застосовуються для крапельного внутрішньовенного введення при гемолізі крові, ацидозі, для регулювання солевої рівноваги.
Особливості технології розчинів натрію гідрокарбонату для ін’єкцій:
Субстанція марки «х. ч.» або «ч. д. а.», а також «придатний для ін’єкцій» (вміст іонів кальцію та магнію не більше 0,05%);
Розчинення проводять при температурі 15-20°С без інтенсивного перемішування;
Наповнюють флакони но 2/3 об’єму;
Стерилізують флакони в перевернутому вигляді або в горизонтальному положенні;
Використовують препарат через 2-3 години після повного охолодження та перемішування (для розчинення вуглекислоти, що знаходиться над розчином)
Rp.: Solutionis Natrii hydrocarbonatis 5% 100ml
Sterilisa!
Da. Signa. Для внутрішньовенних вливань.
Даний лікарський препарат – розчин для ін’єкцій із рН 8,1 -8,9.
Дата № рецепту
Natrii hydrocarbonatis 5.0
Aquae pro injectionibus ad 100ml
Sterilisetur V = 100ml
Приготував
Перевірив
Якщо натрію гідрокарбонат містить солей кальцію містить більше 0,05%, його розчини стабілізують додаванням трилону Б.
Кількість трилону Б на 1л розчину натрію гідрокарбонату для ін’єкцій
Вміст натрію гідрокарбонату, % |
Кількість трилону Б, г |
3 |
0,02 |
4 |
0,03 |
5 |
0,04 |
7 |
0,05 |
Розчини глюкози в порівнянні нестійкі при довгочасному зберіганні.
Основним фактором, що визначає стійкість глюкози в розчині, є рН середовища.
В лужному середовищі проходить її окислення, карамелізація та полімеризація. При цьому спостерігається пожовтіння, а іноді побуріння розчину.
В цьому випадку під впливом кисню проходить окислення, утворюючи оксикислоти (оксиметилфурфурол).
Стабілізацію розчинів глюкози здійснюють шляхом додавання розчину, який складається із натрію хлориду, кислоти хлористоводневої та води очищеної (рідина Вейбеля) до рН 3,0-4,0.
Склад рідини Вейбеля
Для об’ємів більше 1л (На 1л розчину) |
Для об’ємів менше 1 л (5% від об’єму розчину глюкози) |
Натрію хлориду 0,26 Кислоти хлористоводневої 0,1М 5 мл |
Натрію хлориду 5,2 Кислоти хлористоводневої 8,3% 4,4 мл Води для ін’єкцій до 1 л |
При приготуванні розчинів глюкози (незалежно від її концентрації) стабілізатора Вейбеля додають 5% від об’єму розчинів.
Велике значення для стабільності розчинів має значення якість самої глюкози, яка може містити кристалізаційну воду. У відповідності із фармакопейною статтею виробляється глюкоза безводна, яка містить 0,5% води. Вона відрізняється розчинністю, прозорістю та кольором розчину. Термін зберігання 5 років. При використанні глюкози водної її беруть більше, ніж вказано у рецепті. Розрахунок проводять за формулою:
Х=
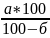 ,
де Х –необхідна кількість глюкози;
,
де Х –необхідна кількість глюкози;
А –кількість безводної глюкози, вказаної в рецепті;
Б –процентний вміст води в глюкозі за даними аналізу.
Rp.: Solutionis Glucosi 40% 100ml
Sterilisa!
Da. Signa. По 10 мл внутрішньовенно.
Нариклад глюкоза містить 9,8% води. Тоді водої глюкози необхідно взяти 44,3.
Х
=
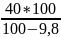 = 44,3
= 44,3
В асептичних умовах в стерильній мірній колбі на 100 мл у воді для ін’єкцій розчиняють глюкозу (44,3), додають стабілізатор Вейбеля (5 мл) та доводять об’єм розчину до 100 мл. . Його закупорюють стерильною гумовою пробкою та обтискують металевим ковпачком. За допомогою УК-2 перевіряють розчин на предмет механічних включень. Далі флакон обв’язують пергаментним папером, на якому роблять напис простим олівцем про найменування та концентрацію розчину.
Зважаючи на те, що глюкоза є добрим середовищем для розвитку мікроорганізмів, отриманий розчин стерилізують негайно після приготування при 120° 8 хвилин. Після стерилізації та охолодження розчин повторно перевіряють для виявлення механічних забруднень, на колірність. Потім розчин оформлюють до відпуску.
Термін зберігання розчину 1 місяць
Дата № рецепту
Glucosi 44.3 (волог. 9,8%)
Liquoris Wejbeli 5 ml
Aquae pro injectionibus ad 100 ml
Sterilis V = 100ml
