
- •Раздел 1 термо-и газодинамические основы сжатия и расширения газов
- •Вопрос 1 Основные понятия и определения технической термодинамики
- •Вопрос 1.
- •Тема 7.
- •Вопрос 4. Применение первого закона термодинамики для открытых однопоточных систем к компрессору и турбине
- •Вопрос 5. Энтропия. 2-й закон термодинамики
- •Вопрос 1. Классификация теплоемкостей.
- •Вопрос 2. Определение теплоемкостей газов в расчетах.
- •Вопрос 3. Уравнение Майера. Показатель изоэнтропы (адиабаты) газа.
- •Тема 4.
- •5 Политропный процесс
- •Тема 5.
- •1. Уравнение неразрывности
- •2. Уравнение движения сплошной среды
- •3. Уравнение момента количества движения для рабочего колеса
- •4. Распределение скоростей и давлений в межлопаточном канале рабочего колеса по нормали к лопаткам.
Вопрос 5. Энтропия. 2-й закон термодинамики
Для количественной оценки направления и необратимости процессов используется функция состояния под названием энтропия.
Энтропия – это функция состояния термодинамической системы, дифференциал которой равен отношению бесконечно малого количества теплоты, подведенного к системе в обратимом равновесном процессе к температуре системы:
![]() ,
Дж/К.
,
Дж/К.
Удельная энтропия
![]() ,
Дж/(кгК).
,
Дж/(кгК).
Энтропию нельзя получить экспериментально, а можно только рассчитать.
Понятие энтропии было введено Клаузиусом в 1852 г. Изменение энтропии может происходить только под действием энергии, передаваемой в виде теплоты. Поэтому с помощью энтропии легко характеризовать процессы с подводом и отводом теплоты. Для наглядности эти процессы изображают в Т-s диаграмме. Площадь под линией процесса эквивалентна теплу: если процесс идет с возрастанием энтропии, то тепло подводится, если процесс идет с убыванием энтропии, то тепло отводится
Связь энтропии с термодинамическими параметрами состояния системы
 =
=![]()
 .
.
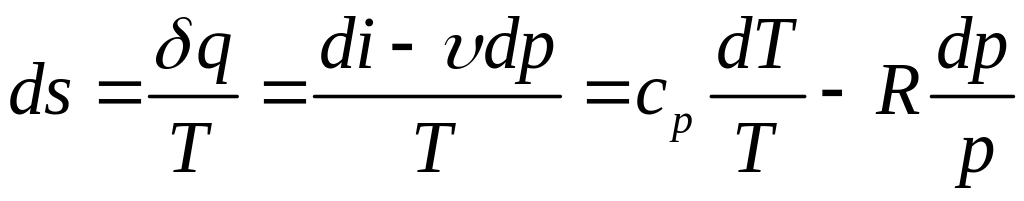 =
=
![]() .
.
Существует несколько формулировок 2-го закона термодинамики. Наиболее общая формулировка: самопроизвольные, т.е. необратимые процессы в изолированной системе всегда приводят к возрастанию энтропии.
Аналитически второй закон термодинамики обычно выражается формулой, соответствующей этой формулировке
 .
.
Знак равенства относится к обратимым процессам, знак > (больше) относится к необратимым процессам. Для обратимых процессов энтропия характеризует только наличием теплообмена, а для необратимых процессов – не только наличие теплообмена, но и диссипативные процессы трения.
Для необратимых процессов можно записать
![]() .
.
Тогда теплота
![]()
или в интегральном виде
 .
.
Так как из первого закона термодинамики
![]() ,
,
а из второго закона
![]() ,
,
то получаем объединенные уравнения первого и второго законов термодинамики
-
 ;
;

ТЕМА 3
ТЕПЛОЕМКОСТЬ ГАЗОВ
Теплоемкость – это количество теплоты, которое необходимо подвести к единице вещества, чтобы нагреть его на 1 градус.
![]() .
.
Вопрос 1. Классификация теплоемкостей.
Теплоемкости классифицируются по разным признакам.
1. По единице количества вещества.
В зависимости от того, что принимается за единицу количества вещества бывают:
массовая (удельная) теплоемкость, если за единицу количества вещества принимается 1 кг: с в Дж/(кгК);
2) объемная теплоемкость, если за единицу количества вещества принимается 1 м3 при нормальных физических условиях: с в Дж/(нм3К);
3) мольная (молярная) теплоемкость, если
за единицу количества вещества принимается
1 кмоль:
![]() в Дж/(кмольК);
в Дж/(кмольК);
![]() ,
,
где 22.4=V - объем одного киломоля при нормальных физических условиях, м3;
н – плотность газа при нормальных физических условиях, кг/м3.
2. По характеру процесса подвода теплоты.
Теплоемкость зависит от характера процесса, при котором подводится теплота, т.е. теплоемкость – это функция процесса.
Если теплота поводится в изобарном процессе, т.е. при при постоянном объеме р = const, то в зависимости от единицы количества вещества может быть
- массовая (удельная) теплоемкость при при постоянном объеме (массовая изобарная теплоемкость)
![]() ,
кДж/(кгК),
,
кДж/(кгК),
- объемная теплоемкость при постоянном давлении (объемная изобарная теплоемкость)
![]()
- мольная теплоемкость при постоянном давлении (мольная изобарная теплоемкость)
![]() .
.
Если теплота поводится в изохорном
процессе, т.е. при постоянном объеме
![]() =const,
то в зависимости от единицы количества
вещества может быть
=const,
то в зависимости от единицы количества
вещества может быть
- массовая (удельная) теплоемкость при постоянном объеме (массовая изохорная теплоемкость)
![]() ,
кДж/(кгК),
,
кДж/(кгК),
- объемная теплоемкость при постоянном объеме (объемная изохорная теплоемкость)
![]()
- мольная теплоемкость при постоянном объеме (мольная изохорная теплоемкость)
![]() .
.
3. По зависимости от температуры.
Теплоемкость реальных газов зависит от температуры. Поэтому различают истинную и среднюю теплоемкость.
Истинная теплоемкость – это отношение элементарного количества теплоты, сообщенной термодинамической системе в каком-либо процессе, к бесконечно малой разности температур
![]() при dT0.
при dT0.
То есть истинная теплоемкеость относится к конкретной температуре.
Тогда теплота, сообщенная системе
 пл.Т112Т2
пл.Т112Т2
То есть теплоемкости, о которых мы говорили выше – это истинные теплоемкости
Средней теплоемкостью процесса в интервале температур от Т1 до Т2 называется отношение количества теплоты, подведенной к газу, к разности конечной и начальной температур. То есть средняя теплоемкеость относится к интервалу температур
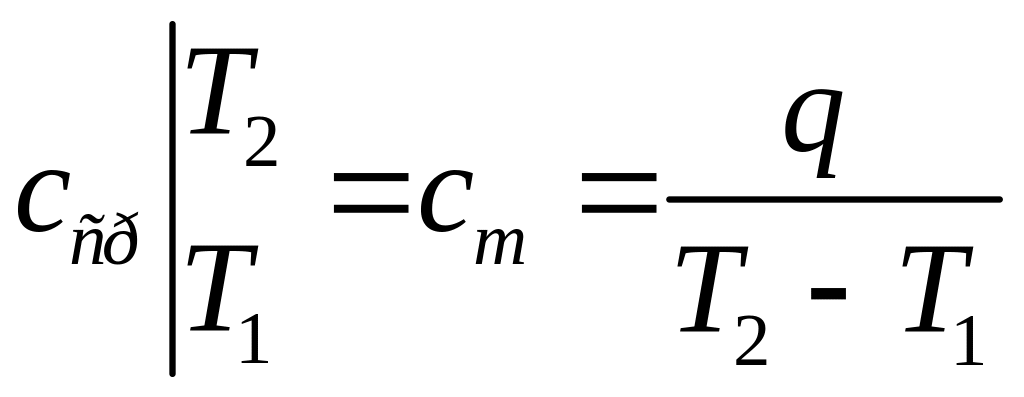
Тогда теплота, сообщенная системе
![]() пл.Т1abТ2=
пл.Т112Т2.
пл.Т1abТ2=
пл.Т112Т2.
Средние теплоемкости также могут быть массовыми, объемными и мольными.
Представим обозначения рассмотренных выше теплоемкостей в виде таблицы.
Теплоемкости |
|||||||||||
Истинные |
Средние |
||||||||||
при р = const |
при v = const |
при р = const |
при v = const |
||||||||
мас |
об. |
моль |
мас |
об. |
моль |
мас |
об. |
моль |
мас |
об. |
моль |
ср |
|
ср |
cv |
|
сv |
|
|
|
|
|
|
