
- •Раздел 1 термо-и газодинамические основы сжатия и расширения газов
- •Вопрос 1 Основные понятия и определения технической термодинамики
- •Вопрос 1.
- •Тема 7.
- •Вопрос 4. Применение первого закона термодинамики для открытых однопоточных систем к компрессору и турбине
- •Вопрос 5. Энтропия. 2-й закон термодинамики
- •Вопрос 1. Классификация теплоемкостей.
- •Вопрос 2. Определение теплоемкостей газов в расчетах.
- •Вопрос 3. Уравнение Майера. Показатель изоэнтропы (адиабаты) газа.
- •Тема 4.
- •5 Политропный процесс
- •Тема 5.
- •1. Уравнение неразрывности
- •2. Уравнение движения сплошной среды
- •3. Уравнение момента количества движения для рабочего колеса
- •4. Распределение скоростей и давлений в межлопаточном канале рабочего колеса по нормали к лопаткам.
Раздел 1 термо-и газодинамические основы сжатия и расширения газов
ТЕМА 1
ИДЕАЛЬНЫЕ И РЕАЛЬНЫЕ ГАЗЫ. УРАВНЕНИЕ СОСТОЯНИЯ ГАЗА
С точки зрения молекулярно-кинетической теории газ представляет собой систему взаимодействующих друг с другом молекул.
Реальный газ – это газ, между молекулами которого действуют силы межмолекулярного взаимодействия (взаимного притяжения, если молекулы находятся на расстоянии, и взаимного отталкивания при достаточном сближении молекул), а сами молекулы имеют конечный объем.
Идеальный газ – это газ, в котором отсутствуют силы межмолекулярного взаимодействия (кроме сил упругого взаимодействия при столкновении молекул), а молекулы представляются материальными точками, не имеющими объема.
Уравнение состояния газа – это уравнение, отражающее функциональную связь между основными термодинамическими параметрами состояния системы (его называют также термическое уравнение состояния). В общем виде
f(p,υ,T)=0 или
p=f1(υ,T), v=f2(p,T), T=f3(p,υ).
Уравнение состояния идеального газа.
Идеальный газ имеет следующие уравнения состояния.
Для М кг газа
![]() .
(1)
.
(1)
Для 1 кг газа (уравнение Клапейрона)
![]() или
или
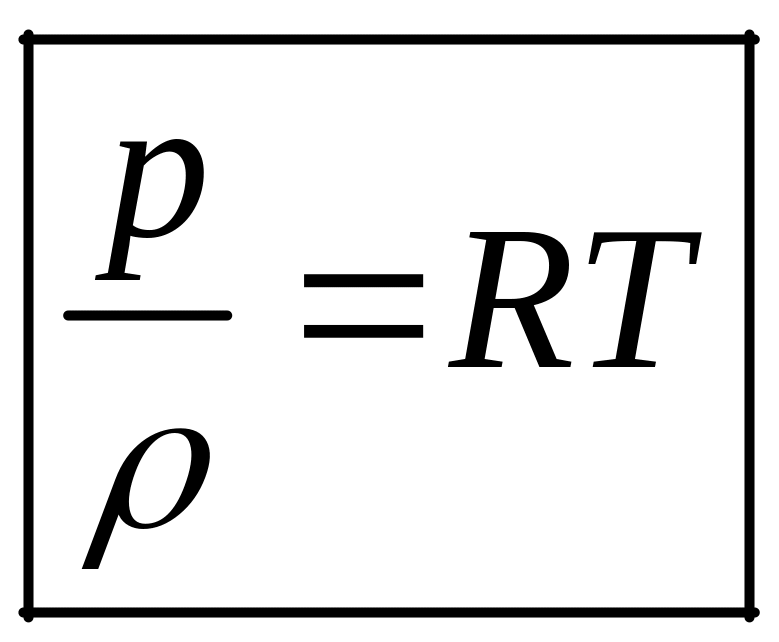 (2)
(2)
Для 1 киломоля газа (уравнение Клапейрона-Менделеева)
![]() (3)
(3)
В этих уравнениях:
р – абсолютное давление, Па;
Т – абсолютная температура газа, К;
V - объем газа, м3;
M – масса газа, кг;
υ – удельный объем газа, м3/кг;
- плотность газа, кг/ м3;
![]() - молярный (мольный) объем,
м3/кмоль;
- молярный (мольный) объем,
м3/кмоль;
![]() - молекулярная масса газа,
кг/кмоль;
- молекулярная масса газа,
кг/кмоль;
R – удельная газовая постоянная (газовая постоянная для 1 кг газа), Дж/(кг∙К).;
Rунив – универсальная газовая постоянная (термин, впервые введённый в употребление Д. Менделеевым в 1874 г. Численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К): Rунив=8314, Дж/(кмоль∙К) (более точно - Rунив=8,31441±0,00026, Дж/(моль∙К) или Rунив=8314,41±0,26, Дж/(кмоль∙К)).
Из уравнения (3) видно, что удельная и универсальная газовые постоянные связаны соотношением
 ,
,
Продифференцировав уравнение (2) получим уравнение состояния идеального газа в дифференциальной форме
![]() .
.
Уравнение состояния реальных газов.
Есть много уравнений (более 100), описывающих реальные газы. С точки зрения молекулярно-кинетической теории наиболее подходящим является уравнение Ван-дер-Ваальса
 ,
,
где
![]() - поправка на давление (молекулярное
или внутреннее давление);
- поправка на давление (молекулярное
или внутреннее давление);
b – поправка на объем (наименьший объем до которого можно сжать газ);
a, b – коэффициенты, индивидуальные для каждого газа.
Для многих газов только при очень высоких давлениях влияет объем молекул, и при очень низких давлениях и температурах проявляются силы взаимного притяжения, то есть обычно а/υ2р и bυ. Например, для воздуха использование уравнения состояния идеального газа вместо уравнения состояния реального газа при р10 МПа и Т273 К дает погрешность не более 5 %, т. е. можно принять а/V2≈0 и b≈0.
Очень часто реальность свойств газа учитывается коэффициентом сжимаемости
 .
.
Тогда уравнение состояния реального газа записывается в виде
![]() ,
,
![]() ,
,
 ,.
,.
Для воздуха при р 10 МПа, Т 273 К можно принимать z ≈1 (см. таблицу).
р, МПА Т,К (t, 0С) |
2.5 |
5 |
270 (-3) |
0.986 |
0.969 |
300 (+27) |
0.994 |
0.992 |
350 (+77) |
1.002 |
1.02 |
Есть специальные уравнения для определения коэффициента сжимаемости, которые называются также уравнениями состояния в вириальной форме и записываются либо относительно удельного объема, либо относительно давления.
ТЕМА 2
ПЕРВЫЙ И ВТОРОЙ ЗАКОНЫ ТЕРМОДИНАМИКИ
