
- •1.Механизм проводимости биологических объектов.
- •2.Эдс поляризации. Уравнение Гольдмана.
- •3. Уравнение Нернста. Стандартный электродный потенциал.
- •4. Электрические явления на участке электрод - кожа.
- •5. Импедансометрические измерения.
- •Алгебраическая форма
- •Тригонометрическая форма
- •9. Импеданс Вартбурга.
- •10. Конструкция электродов.
- •Приготовление микропипетки
- •Заполнение электрода
- •Подключение и контроль
- •13. Операционный усилитель.
- •Обозначения
- •Основы функционирования Питание
- •Простейшее включение оу
- •Идеальный операционный усилитель
- •Простейший неинвертирующий усилитель на оу
- •Отличия реальных оу от идеального
- •Параметры по постоянному току
- •Параметры по переменному току
- •Нелинейные эффекты
- •Ограничения тока и напряжения
- •Классификация оу По типу элементной базы
- •По области применения
- •Другие классификации
- •19. Усилитель-ограничитель на оу.
- •25. Устройства выборки-хранения.
- •27. Генераторы синусоидальных сигналов на оу.
- •29. Цифроаналоговый преобразователь с суммированием токов. Основные понятия и общие способы реализации
- •Способы реализации цап с взвешенным суммированием токов
- •30. Цап с цепочкой r-2r
- •1) Использование матрицы r-2r в качестве параллельного цап.
- •2)Реализация цап по схеме r-2r на микроконтроллере.
- •Ацп последовательного приближения
- •32. Параллельный ацп. И др. Типы ацп
- •Параллельный ацп
- •3.5. Методы экранирования и заземления
- •3.5.1. Гальванически связанные цепи
- •3.5.2. Экранирование сигнальных кабелей
- •40. Фильтры на пассивных элементах. Классификация фильтров.
- •Фильтр на сосредоточенных элементах
- •Фильтры с распределёнными параметрами (фильтры свч)
- •Типы фильтров
- •Нормированные полиномы Баттерворта
- •Максимальная гладкость
- •Спад характеристики на высоких частотах
- •Проектирование фильтра
- •Топология Кауэра
- •Фильтр Чебышева I рода
- •Полюса и нули
- •Передаточная функция
- •Групповая задержка
- •Временны́е характеристики
- •Фильтр Чебышева II рода
- •Полюса и нули
- •Передаточная функция
- •Групповая задержка
- •Фазовые характеристики
- •Временные характеристики
- •Принцип действия
- •Классификация
- •Некоторые виды химических источников тока Гальванические элементы
- •Электрические аккумуляторы
- •Топливные элементы
- •Устройство
- •Лассификация реле
- •Особенности работы
- •Преимущества термопар
- •Недостатки
- •Принципы реализации
- •Тензометрический метод
- •Пьезорезистивный метод
- •Ёмкостной метод
- •Резонансный метод
- •Индуктивный метод
- •Ионизационный метод
- •Пьезоэлектрический метод
- •Регистрация сигналов датчиков давления
- •49. Пьезоэффект.
- •Использование пьезоэффекта в технике
- •Принцип действия
- •Эквивалентная схема
- •Применение
- •Преимущества перед другими решениями
- •Недостатки
3. Уравнение Нернста. Стандартный электродный потенциал.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих вэлектрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
![]() ,
,
где
 —
электродный
потенциал,
—
электродный
потенциал,  —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;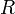 — универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);
— универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);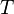 —
абсолютная
температура;
—
абсолютная
температура;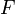 — постоянная
Фарадея,
равная 96485,35 Кл·моль−1;
— постоянная
Фарадея,
равная 96485,35 Кл·моль−1; —
число моль электронов,
участвующих в процессе;
—
число моль электронов,
участвующих в процессе;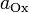 и
и 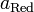 — активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если
в формулу Нернста подставить числовые
значения констант ![]() и
и ![]() и
перейти от натуральных
логарифмов к десятичным,
то при
и
перейти от натуральных
логарифмов к десятичным,
то при ![]() получим
получим
![]()
СТАНДАРТНЫЙ ПОТЕНЦИАЛ (нормальный потенциал), значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активности а всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом электроде, равны 1, а давление газа (для газовых электродов) равно 1,01 · 105 Па (1 атм). Для водных р-ров в качестве стандартного электрода используют водородный электрод (Pt; H2 [1,01·105Па], Н+ [a=1]), потенциал к-рого при всех т-рах принимается равным нулю (см. Электроды сравнения): стандартный потенциал равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схематич. изображении цепи (гальванич. ячейки) водородный электрод всегда записывается слева, исследуемый-справа. Потенциал исследуемого электрода считается положительным, если в режиме "источник тока" слева направо во внеш. цепи движутсяэлектроны, а в р-ре - положительно заряженные частицы. Напр., стандартный потенциал хлорсеребряного электрода равен эдс гальванич. ячейки
-Pt, Н2[1,01·105Па]|НС1(аb=l)|AgCl, Ag|Pt +
Для любой электродной р-ции, включающей перенос n электронов, электродный потенциал определяется ур-нием:
![]()
где Е°-стандартный потенциал электрода, R-газовая постоянная, Т-абс. т-ра, F- постоянная Фарадея, аi-термодинамич.активность частиц (как заряженных, так и незаряженных), участвующих в электродной р-ции, vi-стехиометрич. коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электроны входят в левую часть ур-ния, напр. AgCl + е : Ag + С1-). Значения стандартных потенциалов для рядаэлектродных процессов в водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. Стандартные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляютэлектрохимический ряд напряжений.
Стандартный
потенциал определяется либо
непосредственными измерениями эдс
соответствующих электрохим. цепей с
экстраполяцией на бесконечно разб.
р-ры, либо расчетом - по данным о стандартных
значениях изменения энергии
Гиббсахим.
р-ции G0.
В последнем случае р-цию представляют
в виде суммы двух (или более) электродных
р-ций, одна из к-рых -окис-лит.-восстановит.
р-ция с искомым стандартным потенциалом ![]() ,
а другая-с известным стандартным
потенциалом .
,
а другая-с известным стандартным
потенциалом .![]() .
Если в условной схеме ячейки
1-й электрод записан
слева, то
.
Если в условной схеме ячейки
1-й электрод записан
слева, то
![]()
В электрохимии стандартный
электродный потенциал,
обозначаемый Eo,
E0,
или EO,
является мерой индивидуального потенциала
обратимого электрода (в равновесии)
в стандартном
состоянии,
которое осуществляется в растворах при
эффективной концентрации в 1 моль/кг и
в газах при давлении в 1 атмосферу или
100 кПа (килопаскалей). Объёмы чаще всего
взяты при 25 °C. Основой для электрохимической
ячейки,
такой как гальваническая
ячейка всегда
являетсяокислительно-восстановительная
реакция,
которая может быть разбита на
две полуреакции: окисление на
аноде (потеря электрона) и восстановление на
катоде (приобретение
электрона). Электричество вырабатывается
вследствие различия электростатического
потенциала двух
электродов. Эта разность потенциалов
создаётся в результате различий
индивидуальных потенциалов двух
металлов электродов по
отношению к электролиту.
Вычисление потенциала.
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал принят равным 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
Fe3+ + 3e− → Fe(тв) −0.036 В
Fe2+ + 2e− → Fe(тв) −0.44 В
Для получения третьего уравнения:
Fe3+ + e− → Fe2+ (+0.77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
