
- •Розділ1 - основи гідравліки і насоси
- •Вступ. Основи гідростатики
- •Зміст і завдання дисципліни, порядок вивчення, зв’язок з іншими дисциплінами
- •Паливо-енергетичні ресурси Ураїни
- •Характеристики гідравліки як науки та її значення
- •Фізичні властивості рідини. Ідеальна і реальна рідина
- •Особливі властивості рідини
- •Гідростатичний тиск. Вимірювання гідростатисного тиску
- •Основне рівняння гідостатики. Закон Архімеда
- •Практичне застосування закону Паскаля
- •Основні висновки:
- •Контрольні питання:
- •Основи гідродинаміки
- •Основні поняття
- •Рівняння Бернулі для елементарної струмини ідеальної і реальної рідини. Рівняння Бернулі для потоку реальної рідини
- •Режими руху рідини. Число Рейнольдса
- •Втрати напору
- •Гідравлічний удар у трубах
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Призначення, класифікація і галузі застосування насосів
- •Подача, напір, потужність і ккд носіїв
- •Принцип дії насосів
- •Явище кавітації
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Розділ 2 - основи технічної термодинаміки
- •Основні поняття і визначення в технічній термодинаміці
- •Основні поняття і визначення
- •Робоче тіло, його основні параметри
- •Термодинамічна система
- •Термодинамічний процес
- •Основні газові закони
- •Універсальна газова стала
- •Основні висновки:
- •Контрольні питання:
- •Прочитати:
- •Суміш ідеальних газів. Теплоємність газів і газових сумішей
- •Поняття про газову суміш. Закон Дальтона
- •Склад суміші в об’ємних і масових частках
- •Визначення парціального тиску, парціального об’єму,уявної молекулярної маси компонентів та універсальної газової сталої.
- •Поняття про теплоємність. Масова, об’ємна і молярна теплоємність, залежність між ними
- •Теплоємність при сталому об’ємі та тиску
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Перший закон термодинаміки
- •1. Зміст закону та його формулювання
- •2. Внутрішня енергія та її властивості. Робота газу, її визначення. Ентальпія і ентропія газу.
- •Перший закон термодинаміки для потоку (відкрита система)
- •Загальні висновки:
- •Порядок і методи дослідження термодинамічних процесів. Ізохорний, ізобарний, ізотермічний, адіабатний процеси та їх зображення в кординатах pv, ts
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Другий закон термодинаміки
- •Зміст закону і його формулювання
- •2. Цикл Карно
- •3. Термічний ккд. Холодильний коефіцієнт
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Водяна пара і вологе повітря
- •Водяна пара як робоче тіло
- •Особливості пароутворення при постійному тиску
- •Параметри водяної пари
- •Насичене, ненасичене, перенасичене вологе повітря
- •Параметри стану вологого повітря
- •Витікання і дроселювання газів і пари
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Ідеальні цикли теплових машин. Ідеальні цикли двигунів внутрішнього згорання. Основи їх роботи
- •Поршневі двигуни внутрішнього згорання. Основні поняття і визначення
- •Ідеальні термодинамічні цикли двз
- •Принцип роботи паросилових установок
- •Ідеальні цикли паросилових установок
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Ідеальні цикли компресорних установок. Основи їх роботи
- •Компресори та компресорні установки: класифікація, принцип роботи
- •Ідеальні цикли компресорних установок
- •Основні висновки:
- •Контрольні питання:
- •Способи поширення теплоти
- •Теплопровідність
- •Основні висновки:
- •Контрольні питання:
- •Прочитати:
- •Конвективний теплообмін. Променистий теплообмін
- •Загальні поняття. Закон тепловіддачі
- •Променистий теплообмін
- •Теплообмін під час конденсації пари.
- •Тепловіддача під час кипіння рідини
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Теплопередача і теплообмінні апарати
- •Теплопередача через плоску одношарову і багатошарову стінки. Коефіцієнт теплопередачі.
- •Теплообмінні апарати. Класифікація. Основи розрахунку їх
- •Методи інтенсифікації процесів теплопередачі
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Паливо і його характеристики. Процес горіння палива
- •Загальні відомості
- •Основи теорії горіння органічного палива
- •Основні висновки:
- •1. Котли. Класифікація котлів для сільського господарства
- •2. Тепловий баланс котла
- •3. Теплогенератори.
- •3. Техніка безпеки
- •Основні висновки:
- •1. Загальні відомості
- •2. Схема котельної установки
- •3. Особливості експлуатації котельних установок
- •Особливості будови та роботи тец
- •Основні висновки:
- •1. Структура енергопостачання
- •2. Регулювання мікроклімату приміщення
- •3. Шляхи енергозбереження
- •Основні висновки:
- •Загальні відомості
- •Принципові схеми систем вентиляції
- •Кондиціонування повітря
- •Основні висновки:
- •1. Загальні відомості
- •2. Діаграма стану вологого повітря
- •3. Принцип дії повітряної сушарки
- •4. Типи сушарок
- •5. Матеріальний і тепловий баланс сушарок
- •Основні висновки:
- •1. Загальні відомості
- •2. Теплові втрати приміщень
- •3. Внутрішні теплові надходження приміщень
- •4. Гаряче водопостачання
- •5.Радіатори
- •Основні висновки:
- •Загальні відомості
- •Теплофізичні характеристики
- •Основні висновки:
- •Загальні поняття, класифікація
- •Холодильні агенти та основні властивості
- •Термодинамічні основи роботи холодильних установок
- •Основні висновки:
- •Загальні відомості
- •Тепловий розрахунок сховищ
Загальні висновки:
Процес розширення та стиснення газу в циліндрі описується pv-діаграмою (робочою діаграмою), за допомогою якої можна визначити роботу процесу. 1-й закон термодинаміки для закритих систем говорить, що тепло і механічна енергія можуть перетворюватись одне в одного, а вся прикладена енергія іде частково на виконання роботи, а частково перетворюється у внутрішню енергію системи.
Термодинамічна система, що обмінюється з навколишнім середовищем речовиною, називається відкритою. Теплота, підведена до потоку робочого тіла від зовнішнього джерела, витрачається на зміну ентальпії робочого тіла, збільшення кінетичної енергії потоку і виконання технічної роботи.
Контрольні питання:
Суть першого закону термодинаміки. Основне рівняння першого закону термодинаміки.
Пояснити поняття: «внутрішня енергія», «ентальпія», «ентропія».
Суть першого закону термодинаміки для потоку (відкрита система). Основне рівняння.
Домашнє завдання:
Повторення матеріалу теми за конспектом.
Прочитати:
[1] c. 131-144; [2] c. 98-108; [4] 27-34.
Тема №7
ДОСЛІДЖЕННЯ ТЕРМОДИНАМІЧНИХ ПРОЦЕСІВ
Порядок і методи дослідження термодинамічних процесів. Ізохорний, ізобарний, ізотермічний, адіабатний процеси та їх зображення в кординатах pv, ts
Будь-яка зміна в термодинамічній системі, пов'язана із зміною хоч би одного з її параметрів, називается термодинамічним процесом.
Розрізняють рівноважні і неравноважні процеси.
Рівноважним процесом називається термодинамічний процес, який предсталяє собою безперервну послідовність рівноважних станів. У такому процесі фізичні параметри змінюються нескінченно повільно, так що система весь час знаходиться в рівноважному стані. Крім того, всі частини системи мають однакову температуру і тиск. Рівноважні процеси - оборотні. Оборотні термодинамічні процеси - це такі, за яких термодинамічна система після низки змін свого стану повертається до початкового. Зіставленням необоротних процесів з оборотними можна виявити шляхи підвищення ефективності перших (наприклад, ККД теплових двигунів).
Оборотний термодинамічний процес, в якому робоче тіло, повертаючись у вихідний стан, не набуває двічі одного і того ж стану, називається круговим прогресом, або циклом
Нерівноважним процесом називається термодинамічний процес, який представляє собою послідовність станів, серед яких не всі являются рівноважними. У нерівноважному процесі різні частини системи мають різні температури, тиски, щільність, концентрації.
Стан робочого тіла, коли в кожний момент часу параметри тілі однакові по всій товщі називається рівноважним
Процеси, що протікають в прямому (розширення) І зворотно (стиск) напрямах, проходячи через одні й ті самі проміжні стан в протилежній послідовності, називаються оборотними. При цьому в результаті проведення оборотного процесу як робоче тіло, так і навколишнє середовище повинні повернутися в початковий стан без будь-яких змін.
Умови оборотності процесів такі: механічна рівновага, термічна рівновага, відсутність тертя.
Дійсні процеси нерівноважні (протікають з певними швидкостями й з великою різницею температур) і відбуваються при наявності тертя – необоротні.
Види термодинамічних процесів:
Ізохорний процес: — це термодинамічний процес, який відбувається при сталому об'ємі. v = const
![]() (7.1) - закон Шарля
(7.1) - закон Шарля
Робота процесу
для 1 кг маси газу згідно з формулою
визначається, інтегралом
![]() (7.2),
але в ізохорному процесі об'єм газу
незмінний або зміна об'єму dv=0 і тому
l = 0. При ізохорному процесі робота
не виконується. Вся кількість тепла іде
на підвищення внутрішньої енергії. Для
першого закону термодинаміки:
(7.2),
але в ізохорному процесі об'єм газу
незмінний або зміна об'єму dv=0 і тому
l = 0. При ізохорному процесі робота
не виконується. Вся кількість тепла іде
на підвищення внутрішньої енергії. Для
першого закону термодинаміки:
![]() ,
,
![]() (7.3)
(7.3)
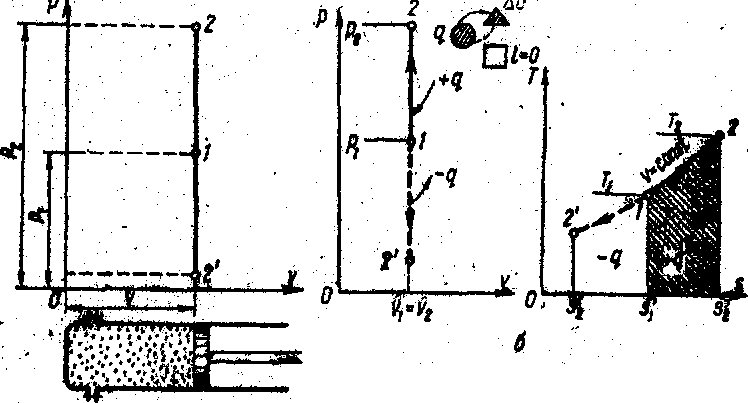
Рис.21 – pv- та Ts-графіки ізохорного процесу
Схема наочно показує, що в ізохорному процесі робота не виконується; підведене тепло (при нагріванні) йде виключно на зміну внутрішньої енергії або на підвищення температури, а відведення тепла в навколишнє середовище (при охолодженні) відбувається за рахунок зміни внутрішньої енергії або за рахунок зниження температури газу.
Ізобарний процес: зміна стану фізичної системи за сталого тиску.
р = const (закон Гей-Люссака)
![]() (7.4)
(7.4)
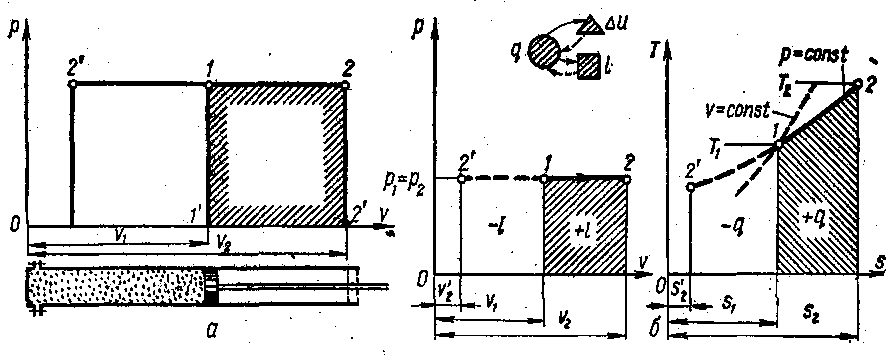
При ізобарному процесі все тепло підведене до робочого тіла іде на збільшення внутрішньої енергії і виконання роботи.
![]() (7.5)
(7.5)
Схема перетворення енергії в ізобарному процесі показує, що в цьому процесі тепло, підведене до газу, затрачається частково на виконання роботи, а частково на зміну внутрішньої енергії.
Ізотермі́чний проце́с— це термодинамічний процес, який відбувається при сталій температурі.
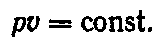 (7.6)
(7.6)
![]() (закон
Бойля—Маріотта) (7.7)
(закон
Бойля—Маріотта) (7.7)

Рис.23 – pv- та Ts-графіки ізотермічного процесу
В ізотермічному процесі зміни внутрішньої енергії не відбуваються і тепло на ці зміни не витрачається
В ізотермічному
процесі все тепло, підведене до газу,
витрачається на здійснення роботи.
![]() (7.8)
(7.8)
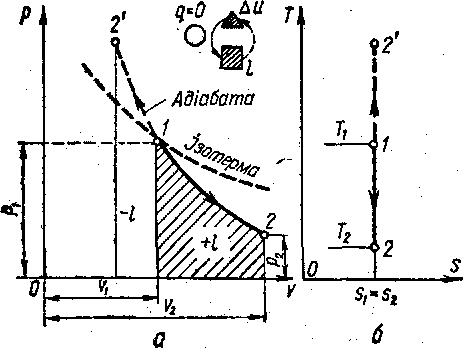
Адіабатний процес - термодинамічний процес, який відбувається у системі за її повної ізоляції, тобто коли між системою та навколишнім середовищем відсутній теплообмін.
Адіабатним називається процес, який відбувається без теплообміну між газом і навколишнім середовищем. Здійснення такого процесу можна уявити собі в умовах, коли газ знаходиться в посудині або циліндрі, виготовлених з абсолютно нетеплопровідного матеріалу. Але, як відомо, такого матеріалу в природі немає, а тому й адіабатних процесів здійснити не можна. Проте, коли процеси відбуваються з великими швидкостями, вони наближаються до адіабатних, бо за короткий проміжок часу теплообміну між газом і навколишнім середовищем майже немає. З цих міркувань всі швидкісні процеси вважають адіабатними.
![]()
 (7.9) де k – показник
адіабати <0. Це і є рівняння адіабатного
процесу в координатах pv.
(7.9) де k – показник
адіабати <0. Це і є рівняння адіабатного
процесу в координатах pv.
![]() (7.10) (при стискуванні
робота від’ємна)
(7.10) (при стискуванні
робота від’ємна)
Рис.24 – pv- та Ts-графіки адіабатного процесу
В адіабатному процесі немає теплообміну між газом і навколишнім середовищем робота (при розширенні) виконується за рахунок зменшення внутрішньої енергії газу (на це вказує знак мінус). При адіабатному стиску затрачене тепло, підведене з навколишнього середовища, іде на збільшення внутрішньої енергії газу.
Політропний процес— термодинамічний процес, під час якого питома теплоємність c з газу залишається незмінною
![]() (7.11)
(7.11)
Надаючи показнику політропи цілих числових значень, діст'ємо рівняння різних процесів.
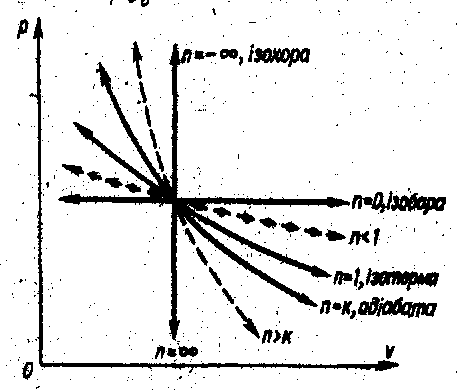

Рис.25 – pv- та Ts-графіки політропного процесу
Є узагальнюючим процесом для всіх термодинамічних процесів. Надаючи показнику політропи різних числових значень будемо одержувати рівняння різних процесів:
![]() - ізобара (7.12)
- ізобара (7.12)
![]() - ізотерм (7.13)
- ізотерм (7.13)
