
- •Розділ1 - основи гідравліки і насоси
- •Вступ. Основи гідростатики
- •Зміст і завдання дисципліни, порядок вивчення, зв’язок з іншими дисциплінами
- •Паливо-енергетичні ресурси Ураїни
- •Характеристики гідравліки як науки та її значення
- •Фізичні властивості рідини. Ідеальна і реальна рідина
- •Особливі властивості рідини
- •Гідростатичний тиск. Вимірювання гідростатисного тиску
- •Основне рівняння гідостатики. Закон Архімеда
- •Практичне застосування закону Паскаля
- •Основні висновки:
- •Контрольні питання:
- •Основи гідродинаміки
- •Основні поняття
- •Рівняння Бернулі для елементарної струмини ідеальної і реальної рідини. Рівняння Бернулі для потоку реальної рідини
- •Режими руху рідини. Число Рейнольдса
- •Втрати напору
- •Гідравлічний удар у трубах
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Призначення, класифікація і галузі застосування насосів
- •Подача, напір, потужність і ккд носіїв
- •Принцип дії насосів
- •Явище кавітації
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Розділ 2 - основи технічної термодинаміки
- •Основні поняття і визначення в технічній термодинаміці
- •Основні поняття і визначення
- •Робоче тіло, його основні параметри
- •Термодинамічна система
- •Термодинамічний процес
- •Основні газові закони
- •Універсальна газова стала
- •Основні висновки:
- •Контрольні питання:
- •Прочитати:
- •Суміш ідеальних газів. Теплоємність газів і газових сумішей
- •Поняття про газову суміш. Закон Дальтона
- •Склад суміші в об’ємних і масових частках
- •Визначення парціального тиску, парціального об’єму,уявної молекулярної маси компонентів та універсальної газової сталої.
- •Поняття про теплоємність. Масова, об’ємна і молярна теплоємність, залежність між ними
- •Теплоємність при сталому об’ємі та тиску
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Перший закон термодинаміки
- •1. Зміст закону та його формулювання
- •2. Внутрішня енергія та її властивості. Робота газу, її визначення. Ентальпія і ентропія газу.
- •Перший закон термодинаміки для потоку (відкрита система)
- •Загальні висновки:
- •Порядок і методи дослідження термодинамічних процесів. Ізохорний, ізобарний, ізотермічний, адіабатний процеси та їх зображення в кординатах pv, ts
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Другий закон термодинаміки
- •Зміст закону і його формулювання
- •2. Цикл Карно
- •3. Термічний ккд. Холодильний коефіцієнт
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Водяна пара і вологе повітря
- •Водяна пара як робоче тіло
- •Особливості пароутворення при постійному тиску
- •Параметри водяної пари
- •Насичене, ненасичене, перенасичене вологе повітря
- •Параметри стану вологого повітря
- •Витікання і дроселювання газів і пари
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Ідеальні цикли теплових машин. Ідеальні цикли двигунів внутрішнього згорання. Основи їх роботи
- •Поршневі двигуни внутрішнього згорання. Основні поняття і визначення
- •Ідеальні термодинамічні цикли двз
- •Принцип роботи паросилових установок
- •Ідеальні цикли паросилових установок
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Ідеальні цикли компресорних установок. Основи їх роботи
- •Компресори та компресорні установки: класифікація, принцип роботи
- •Ідеальні цикли компресорних установок
- •Основні висновки:
- •Контрольні питання:
- •Способи поширення теплоти
- •Теплопровідність
- •Основні висновки:
- •Контрольні питання:
- •Прочитати:
- •Конвективний теплообмін. Променистий теплообмін
- •Загальні поняття. Закон тепловіддачі
- •Променистий теплообмін
- •Теплообмін під час конденсації пари.
- •Тепловіддача під час кипіння рідини
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Теплопередача і теплообмінні апарати
- •Теплопередача через плоску одношарову і багатошарову стінки. Коефіцієнт теплопередачі.
- •Теплообмінні апарати. Класифікація. Основи розрахунку їх
- •Методи інтенсифікації процесів теплопередачі
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Паливо і його характеристики. Процес горіння палива
- •Загальні відомості
- •Основи теорії горіння органічного палива
- •Основні висновки:
- •1. Котли. Класифікація котлів для сільського господарства
- •2. Тепловий баланс котла
- •3. Теплогенератори.
- •3. Техніка безпеки
- •Основні висновки:
- •1. Загальні відомості
- •2. Схема котельної установки
- •3. Особливості експлуатації котельних установок
- •Особливості будови та роботи тец
- •Основні висновки:
- •1. Структура енергопостачання
- •2. Регулювання мікроклімату приміщення
- •3. Шляхи енергозбереження
- •Основні висновки:
- •Загальні відомості
- •Принципові схеми систем вентиляції
- •Кондиціонування повітря
- •Основні висновки:
- •1. Загальні відомості
- •2. Діаграма стану вологого повітря
- •3. Принцип дії повітряної сушарки
- •4. Типи сушарок
- •5. Матеріальний і тепловий баланс сушарок
- •Основні висновки:
- •1. Загальні відомості
- •2. Теплові втрати приміщень
- •3. Внутрішні теплові надходження приміщень
- •4. Гаряче водопостачання
- •5.Радіатори
- •Основні висновки:
- •Загальні відомості
- •Теплофізичні характеристики
- •Основні висновки:
- •Загальні поняття, класифікація
- •Холодильні агенти та основні властивості
- •Термодинамічні основи роботи холодильних установок
- •Основні висновки:
- •Загальні відомості
- •Тепловий розрахунок сховищ
Визначення парціального тиску, парціального об’єму,уявної молекулярної маси компонентів та універсальної газової сталої.
Визначення парціальних тисків і парціальних об'ємів компоненттів. Зважаючи на те, що температури компонентів і суміші однакові, на підставі закону Бойля—Маріотта справедливі такі залежності між парціальними тисками та об'ємами компонентів і тиском та об'ємом суміші:
![]() (5.13)
(5.13)
![]() (5.14)
(5.14)
![]() (5.15)
(5.15)
Парціальний тиск компонента дорівнює добутку тиску суміші на об'ємну частку цього компонента.
Якщо у формулі замінити значення об'ємної частки відповідними залежностями масової частки, парціальний тиск визначатиметься з залежностей:
![]() (5.16)
(5.16)
![]() (5.17)
(5.17)
![]() (5.18)
(5.18)
Парціальний об'єм компонента дорівнює добутку відношення парціального тиску компонента до тиску суміші на об'єм суміші.
Так як
![]() - маса суміші дорівнює сумі мас компонентів,
а
- маса суміші дорівнює сумі мас компонентів,
а
![]() (3.13),
то
(3.13),
то
![]() (5.19)
(5.19)
![]()
Густина суміші дорівнює сумі добутків густини компонентів на їхні об'ємні частки
Знаючи густину суміші, можна визначити питомий об’єм суміші:
 (
5.21)
(
5.21)
![]()
![]() (5.22)
(5.22)
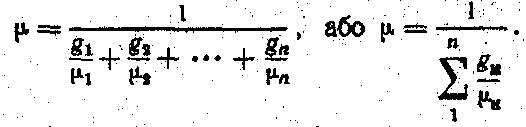 (5.23)
(5.23)
Знаючи уявну молекулярну масу суміші, можна визначити питому газову сталу суміші, користуючись формулою.
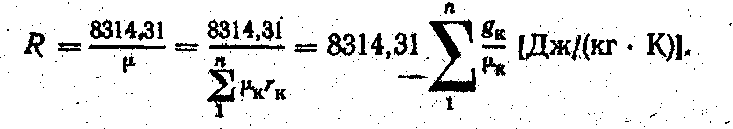 (5.24)
(5.24)
Користуючись поняттям парціального об’єму, термічне рівняння к-го компонента суміші можна записати так:
![]() ,
(5.25)
,
(5.25)
Термічне рівняння стану для газової суміші:
![]() ,
(5.26)
,
(5.26)
При відомому хімічному складі суміші вищенаведеними формулами ожна користуватися для виконання практичних розрахунків термодинамічних процесів установок, в яких робоче тіло є сумішшю різних газів (наприклад, повітря, гази у двигунах внутрішнього згорання, в топках сушарок тощо).
Поняття про теплоємність. Масова, об’ємна і молярна теплоємність, залежність між ними
Теплоємністю називається кількість тепла, яку потрібно підвести до робочого тіла (при нагріванні) або відвести від робочого тіла (при охолодженні) для зміни температури одиниці кількості робочого тіла на один градус.
Теплоємність газів залежить від умов нагрівання чи охолодження або від процесу підведення чи відведення тепла: при сталому об'ємі чи при сталому тиску.
Величину теплоємності, віднесену до одиниці кількості, називають питомою теплоємністю.
Теплоємність,
віднесену до
одиниці маси (кг) тіла, називають
питомою масовою теплоємністю
(с), Дж/(кг-К)
![]() (5.1);
(5.1);
віднесену до
одного кіломолю - молярною
теплоємністю (μс), Дж/(кмоль-К);
![]() (5.2);
(5.2);
віднесену до 1 м3
об'єму газу - об'ємною теплоємністю
(С/), Дж/(м3К).
![]() (5.3).
(5.3).
У цих формулах q, q`, q`` - тепло, затрачене на підвищення температури з t1 до t2 одиниці кількості газу відповідно 1 кг маси, 1 м3 за нормальних умов та 1 кмоля газу.
Чисельно величина теплоємності може змінюватися від +∞ до -∞.
Теплоємність при сталому об’ємі та тиску
Теплоємність газів залежить від умов нагрівання чи охолодження або від процесу підведення чи відведення тепла: при сталому об’ємі чи при сталому тиску.
Нехай у циліндрі з нерухомим поршнем знаходиться 1 кг газу. Кількість тепла, затрачена для нагрівання цієї маси газу на один градус, визначатиме масову теплоємність при сталому об'ємі.
Якщо 1 кг газу нагрівати на 1 градус в циліндрі з рухомим поршнем, затрачене при цьому тепло визначатиме масову теплоємність при сталому тиску.
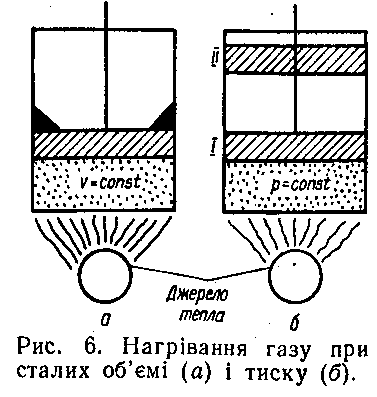
Рис.19 – Циліндр з нерухомим поршнем
Оскільки в процесі нагрівання при сталому тиску тепло витрачається не тільки на підвищення температури (збільшення кінетичної енергії молекул), а й на виконання роботи l (переміщення поршня з положення I у положення II), масова теплоємність ср при сталому тиску більша від масової теплоємності cv при сталому об'ємі на величину роботи l, яку виконує 1 кг газу при нагріванні його на один градус при сталому тиску. Отже, ср—cv = l. Оскільки ця робота характеризується питомою газовою сталою, тобто l = R, а тому
![]() (5.4)
(5.4)
![]()
Другим важливим співвідношенням у теорії теплоємності є відношення масової теплоємності при сталому тиску ср до масової теплоємності при сталому об'ємі cv:
За доведенням молекулярно-кінетичної теорії газів числове значення к залежить тільки від атомності газів: к=1,67 – для одноатомних; к=1,4 – для двоатомних; і к=1,33 для три- і багатоатомних газів.
Одноатомний газ — це такий газ, в якому атоми не утворюють хімічних зв'язків один з одним.
При стандартному тиску і температурі всі інертні гази є одноатомними. До інертних газів відносяться: гелій, неон, аргон, криптон, ксенон і радон. Інертні гази з великими атомними масами можуть створювати структурні утворення, але легші є нереактивними. При дуже високих температурах всі хімічні елементи в газовому стані є одноатомними.
Єдиний вигляд руху молекул одноатомного газу — це поступальний рух (збудження електронів не є важливим при кімнатних температурах).
Про ідеальні одноатомні гази можна сказати наступне:
молярна теплоємність при постійному тиску (сp) дорівнює 5/2 R = 20.8 Дж*K-1*моль-1;
молярна теплоємність при постійному об'ємі (сv) складає 3/2 R = 12.5 Дж*K-1*моль-1;
де R — універсальна газова постійна.
Із
співвідношень можна визначити значення
масових теплоємностей cp
i cv
![]()
Помноживши праву і ліву частини рівняння Майєра на μ, дістанемо співвідношення мольних теплоємностей
![]()
Кількість тепла для нагрівання 1кг, 1 м3, 1 кмоля газу від t1 до t2:
![]() (5.8)
(5.8)
![]() (5.9)
(5.9)
![]() (5.10)
(5.10)
Примітка.
При користуванні цією таблицею
для визначення середньої теплоємності
в межах температур від
t1
до t2 коефіцієнт
b при t
треба подвоїти
