
- •Розділ1 - основи гідравліки і насоси
- •Вступ. Основи гідростатики
- •Зміст і завдання дисципліни, порядок вивчення, зв’язок з іншими дисциплінами
- •Паливо-енергетичні ресурси Ураїни
- •Характеристики гідравліки як науки та її значення
- •Фізичні властивості рідини. Ідеальна і реальна рідина
- •Особливі властивості рідини
- •Гідростатичний тиск. Вимірювання гідростатисного тиску
- •Основне рівняння гідостатики. Закон Архімеда
- •Практичне застосування закону Паскаля
- •Основні висновки:
- •Контрольні питання:
- •Основи гідродинаміки
- •Основні поняття
- •Рівняння Бернулі для елементарної струмини ідеальної і реальної рідини. Рівняння Бернулі для потоку реальної рідини
- •Режими руху рідини. Число Рейнольдса
- •Втрати напору
- •Гідравлічний удар у трубах
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Призначення, класифікація і галузі застосування насосів
- •Подача, напір, потужність і ккд носіїв
- •Принцип дії насосів
- •Явище кавітації
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Розділ 2 - основи технічної термодинаміки
- •Основні поняття і визначення в технічній термодинаміці
- •Основні поняття і визначення
- •Робоче тіло, його основні параметри
- •Термодинамічна система
- •Термодинамічний процес
- •Основні газові закони
- •Універсальна газова стала
- •Основні висновки:
- •Контрольні питання:
- •Прочитати:
- •Суміш ідеальних газів. Теплоємність газів і газових сумішей
- •Поняття про газову суміш. Закон Дальтона
- •Склад суміші в об’ємних і масових частках
- •Визначення парціального тиску, парціального об’єму,уявної молекулярної маси компонентів та універсальної газової сталої.
- •Поняття про теплоємність. Масова, об’ємна і молярна теплоємність, залежність між ними
- •Теплоємність при сталому об’ємі та тиску
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Перший закон термодинаміки
- •1. Зміст закону та його формулювання
- •2. Внутрішня енергія та її властивості. Робота газу, її визначення. Ентальпія і ентропія газу.
- •Перший закон термодинаміки для потоку (відкрита система)
- •Загальні висновки:
- •Порядок і методи дослідження термодинамічних процесів. Ізохорний, ізобарний, ізотермічний, адіабатний процеси та їх зображення в кординатах pv, ts
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Другий закон термодинаміки
- •Зміст закону і його формулювання
- •2. Цикл Карно
- •3. Термічний ккд. Холодильний коефіцієнт
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Водяна пара і вологе повітря
- •Водяна пара як робоче тіло
- •Особливості пароутворення при постійному тиску
- •Параметри водяної пари
- •Насичене, ненасичене, перенасичене вологе повітря
- •Параметри стану вологого повітря
- •Витікання і дроселювання газів і пари
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Ідеальні цикли теплових машин. Ідеальні цикли двигунів внутрішнього згорання. Основи їх роботи
- •Поршневі двигуни внутрішнього згорання. Основні поняття і визначення
- •Ідеальні термодинамічні цикли двз
- •Принцип роботи паросилових установок
- •Ідеальні цикли паросилових установок
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Ідеальні цикли компресорних установок. Основи їх роботи
- •Компресори та компресорні установки: класифікація, принцип роботи
- •Ідеальні цикли компресорних установок
- •Основні висновки:
- •Контрольні питання:
- •Способи поширення теплоти
- •Теплопровідність
- •Основні висновки:
- •Контрольні питання:
- •Прочитати:
- •Конвективний теплообмін. Променистий теплообмін
- •Загальні поняття. Закон тепловіддачі
- •Променистий теплообмін
- •Теплообмін під час конденсації пари.
- •Тепловіддача під час кипіння рідини
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Теплопередача і теплообмінні апарати
- •Теплопередача через плоску одношарову і багатошарову стінки. Коефіцієнт теплопередачі.
- •Теплообмінні апарати. Класифікація. Основи розрахунку їх
- •Методи інтенсифікації процесів теплопередачі
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Паливо і його характеристики. Процес горіння палива
- •Загальні відомості
- •Основи теорії горіння органічного палива
- •Основні висновки:
- •1. Котли. Класифікація котлів для сільського господарства
- •2. Тепловий баланс котла
- •3. Теплогенератори.
- •3. Техніка безпеки
- •Основні висновки:
- •1. Загальні відомості
- •2. Схема котельної установки
- •3. Особливості експлуатації котельних установок
- •Особливості будови та роботи тец
- •Основні висновки:
- •1. Структура енергопостачання
- •2. Регулювання мікроклімату приміщення
- •3. Шляхи енергозбереження
- •Основні висновки:
- •Загальні відомості
- •Принципові схеми систем вентиляції
- •Кондиціонування повітря
- •Основні висновки:
- •1. Загальні відомості
- •2. Діаграма стану вологого повітря
- •3. Принцип дії повітряної сушарки
- •4. Типи сушарок
- •5. Матеріальний і тепловий баланс сушарок
- •Основні висновки:
- •1. Загальні відомості
- •2. Теплові втрати приміщень
- •3. Внутрішні теплові надходження приміщень
- •4. Гаряче водопостачання
- •5.Радіатори
- •Основні висновки:
- •Загальні відомості
- •Теплофізичні характеристики
- •Основні висновки:
- •Загальні поняття, класифікація
- •Холодильні агенти та основні властивості
- •Термодинамічні основи роботи холодильних установок
- •Основні висновки:
- •Загальні відомості
- •Тепловий розрахунок сховищ
Прочитати:
[1] c. 120-122, c. 124-128;
[2] c. 82-90;
[4] 7-10.
Тема №5
Суміш ідеальних газів. Теплоємність газів і газових сумішей
План
Поняття про газову суміш. Закон Дальтона.
Склад суміші в об'ємних і масових частках.
Визначення парціального тиску, парціального об’єму, уявної молекулярної маси компонентів та універсальної газової сталої.
Поняття про теплоємність. Масова, об'ємна і молярна теплоємність, залежність між ними.
Теплоємність при сталому об'єму та тиску.
Поняття про газову суміш. Закон Дальтона
Під час спалювання палива в циліндрах теплових двигунів і в топках котельних установок утворюються так звані продукти згоряння, які є не одним однорідним газом, а сумішшю різних газів : вуглекислого газу (С02), водяної пари (Н20), кисню (02) і азоту (N2). Якщо паливо згорятиме в умовах нестачі повітря, в продуктах згоряння буде багато водню (Н2), окису вуглецю (СО) та інших продуктів не повного згоряння . Отже, в теплотехнічних розрахунках доводиться мати справу з сумішами різних газів і визначати для таких сумішей всі характерні величини (параметри, газову сталу тощо).
Сумішшю називають сукупність окремих газів , які хімічно не взаємодіють між собою. Окремі гази, що входять до-складу суміші, називають компонентами. Домовимося величини, що стосуються компонентів, позначати індексами 1, 2,.. .,п а або загальним індексом k, а величини, що стосуються суміші без індексів.
Нехай в 1м3 газової суміші буде n1, n2… молекул компонентів масою m1, m2….відповідно, що мають швидкості w1,w2….. Зважаючи на те, що температура всіх компонентів така, як і температура суміші, можна записати:
![]() (5.1)
і тиск суміші можна записати так:
(5.1)
і тиск суміші можна записати так:
![]() ,
(5.2)
,
(5.2)
де п - загальне число молекул суміші. Відповідно:
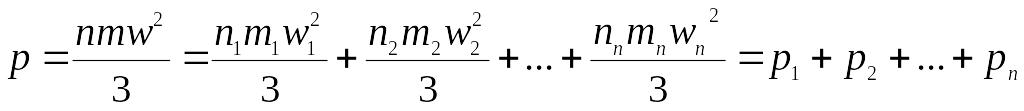 ,
(5.3)
,
(5.3)
де р1, р2, рп – парціальні тиски, тобто тиски окремих компонентів при умові, що кожен із них займає об’єм суміші при температуроі суміші.
Це рівняння виражає закон Дальтона, який полягає в тому, що тиск суміші газів дорівнює сумі парціальних тисків її компонентів.
Закон Дальтона:
![]() (5.4)
(5.4)
При вивченні газових сумішей користуються також поняттям парціальних об’ємів компонентів, під якими розуміють об’єми кожного з компонентів при тиску й температурі суміші:
![]()
Висновок із закону Дальтона: у газовій суміші кожен із компонентів поводить себе так, начебто інших компонентів не існує, тобто займає весь об’єм суміші і чинить відповідний тиск на стінки посудини.
Суміш ідеальних газів, які хімічно не взаємодіють між собою, називається ідеальною газовою сумішшю.
Суміші реальних газів не підкоряються закону Дальтона.
Склад суміші в об’ємних і масових частках
Нехай М(кг) маси суміші складається з М1, М2,… Мп (кг) маси компонентів, тобто
![]() ,
(5.5)
,
(5.5)
Відношення маси кожного компоненту до маси суміші називається масовими частками
![]() ,
(5.6)
,
(5.6)
Якщо V(м3) суміші складається з V1, V2,… Vп (кг) парціальних об’ємів компонентів, то:
Відношення об’єму, зайнятого кожним компонентом до загального об’єму суміші називається об’ємними частками
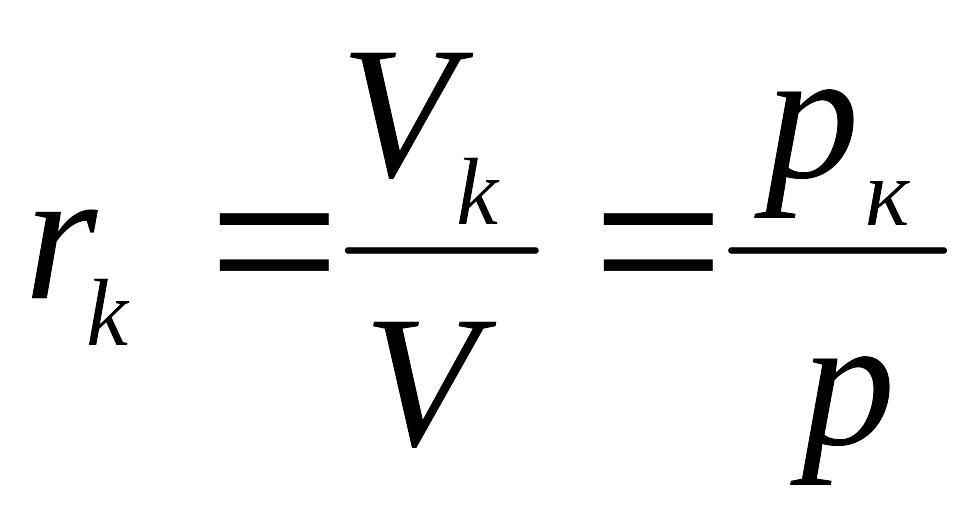 ,
(5.7)
,
(5.7)
Суми масових і об’ємних часток газової суміші нарізно дорівнюють одиниці
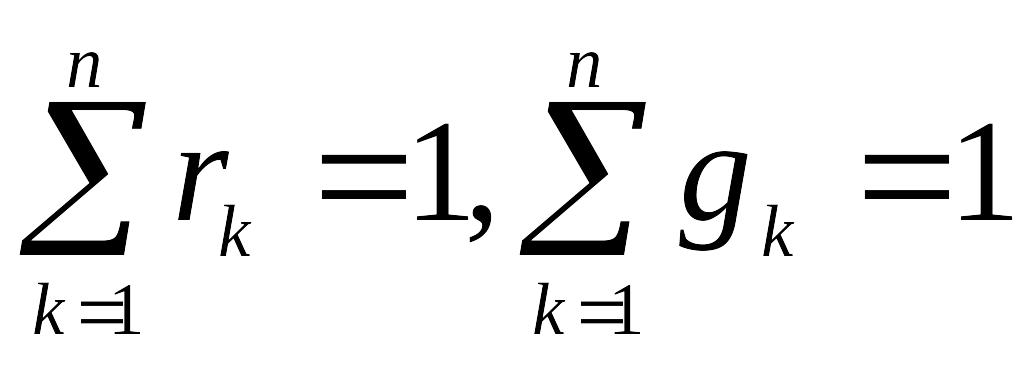 ,
(5.8)
,
(5.8)
Співвідношення між об’ємними і масовими частками характеризується такими залежностями:
![]() (5.9)
(5.9)
Користуючись цими залежностями, об'ємні частки можна перевести в масові і навпаки, якщо відомі питомі об'єми чи густини компонентів і суміші.
Склад суміші може
бути заданий також в кіломолях. Нехай
суміш N
кмоль складається з
N1,
N2,..
Nn
кмоль компонентів. При однакових тисках
і температурах суміші й компонентів
об'єми К 1 кмоль. їх рівні між собою. Тому
загальні об'єми компонентів і суміші
можна записати так:![]() (5.10)
(5.10)
Об'ємні частки
компонентів будуть:![]() (5.11), аналогічно
(5.11), аналогічно
![]() (5.12)
(5.12)
З цього видно, що розрахунок суміші в кіломолях аналогічний розрахунку суміші за об'ємом, тобто зводиться до визначення об'ємних часток.
