
- •Розділ1 - основи гідравліки і насоси
- •Вступ. Основи гідростатики
- •Зміст і завдання дисципліни, порядок вивчення, зв’язок з іншими дисциплінами
- •Паливо-енергетичні ресурси Ураїни
- •Характеристики гідравліки як науки та її значення
- •Фізичні властивості рідини. Ідеальна і реальна рідина
- •Особливі властивості рідини
- •Гідростатичний тиск. Вимірювання гідростатисного тиску
- •Основне рівняння гідостатики. Закон Архімеда
- •Практичне застосування закону Паскаля
- •Основні висновки:
- •Контрольні питання:
- •Основи гідродинаміки
- •Основні поняття
- •Рівняння Бернулі для елементарної струмини ідеальної і реальної рідини. Рівняння Бернулі для потоку реальної рідини
- •Режими руху рідини. Число Рейнольдса
- •Втрати напору
- •Гідравлічний удар у трубах
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Призначення, класифікація і галузі застосування насосів
- •Подача, напір, потужність і ккд носіїв
- •Принцип дії насосів
- •Явище кавітації
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Розділ 2 - основи технічної термодинаміки
- •Основні поняття і визначення в технічній термодинаміці
- •Основні поняття і визначення
- •Робоче тіло, його основні параметри
- •Термодинамічна система
- •Термодинамічний процес
- •Основні газові закони
- •Універсальна газова стала
- •Основні висновки:
- •Контрольні питання:
- •Прочитати:
- •Суміш ідеальних газів. Теплоємність газів і газових сумішей
- •Поняття про газову суміш. Закон Дальтона
- •Склад суміші в об’ємних і масових частках
- •Визначення парціального тиску, парціального об’єму,уявної молекулярної маси компонентів та універсальної газової сталої.
- •Поняття про теплоємність. Масова, об’ємна і молярна теплоємність, залежність між ними
- •Теплоємність при сталому об’ємі та тиску
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Перший закон термодинаміки
- •1. Зміст закону та його формулювання
- •2. Внутрішня енергія та її властивості. Робота газу, її визначення. Ентальпія і ентропія газу.
- •Перший закон термодинаміки для потоку (відкрита система)
- •Загальні висновки:
- •Порядок і методи дослідження термодинамічних процесів. Ізохорний, ізобарний, ізотермічний, адіабатний процеси та їх зображення в кординатах pv, ts
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Другий закон термодинаміки
- •Зміст закону і його формулювання
- •2. Цикл Карно
- •3. Термічний ккд. Холодильний коефіцієнт
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Водяна пара і вологе повітря
- •Водяна пара як робоче тіло
- •Особливості пароутворення при постійному тиску
- •Параметри водяної пари
- •Насичене, ненасичене, перенасичене вологе повітря
- •Параметри стану вологого повітря
- •Витікання і дроселювання газів і пари
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Ідеальні цикли теплових машин. Ідеальні цикли двигунів внутрішнього згорання. Основи їх роботи
- •Поршневі двигуни внутрішнього згорання. Основні поняття і визначення
- •Ідеальні термодинамічні цикли двз
- •Принцип роботи паросилових установок
- •Ідеальні цикли паросилових установок
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Ідеальні цикли компресорних установок. Основи їх роботи
- •Компресори та компресорні установки: класифікація, принцип роботи
- •Ідеальні цикли компресорних установок
- •Основні висновки:
- •Контрольні питання:
- •Способи поширення теплоти
- •Теплопровідність
- •Основні висновки:
- •Контрольні питання:
- •Прочитати:
- •Конвективний теплообмін. Променистий теплообмін
- •Загальні поняття. Закон тепловіддачі
- •Променистий теплообмін
- •Теплообмін під час конденсації пари.
- •Тепловіддача під час кипіння рідини
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Теплопередача і теплообмінні апарати
- •Теплопередача через плоску одношарову і багатошарову стінки. Коефіцієнт теплопередачі.
- •Теплообмінні апарати. Класифікація. Основи розрахунку їх
- •Методи інтенсифікації процесів теплопередачі
- •Основні висновки:
- •Контрольні питання:
- •Домашнє завдання:
- •Прочитати:
- •Паливо і його характеристики. Процес горіння палива
- •Загальні відомості
- •Основи теорії горіння органічного палива
- •Основні висновки:
- •1. Котли. Класифікація котлів для сільського господарства
- •2. Тепловий баланс котла
- •3. Теплогенератори.
- •3. Техніка безпеки
- •Основні висновки:
- •1. Загальні відомості
- •2. Схема котельної установки
- •3. Особливості експлуатації котельних установок
- •Особливості будови та роботи тец
- •Основні висновки:
- •1. Структура енергопостачання
- •2. Регулювання мікроклімату приміщення
- •3. Шляхи енергозбереження
- •Основні висновки:
- •Загальні відомості
- •Принципові схеми систем вентиляції
- •Кондиціонування повітря
- •Основні висновки:
- •1. Загальні відомості
- •2. Діаграма стану вологого повітря
- •3. Принцип дії повітряної сушарки
- •4. Типи сушарок
- •5. Матеріальний і тепловий баланс сушарок
- •Основні висновки:
- •1. Загальні відомості
- •2. Теплові втрати приміщень
- •3. Внутрішні теплові надходження приміщень
- •4. Гаряче водопостачання
- •5.Радіатори
- •Основні висновки:
- •Загальні відомості
- •Теплофізичні характеристики
- •Основні висновки:
- •Загальні поняття, класифікація
- •Холодильні агенти та основні властивості
- •Термодинамічні основи роботи холодильних установок
- •Основні висновки:
- •Загальні відомості
- •Тепловий розрахунок сховищ
Термодинамічний процес
Будь-яка зміна в термодинамічній системі, пов'язана із зміною хоч би одного з її параметрів, називается термодинамічним процесом
Якщо одна система здійснює роботу над іншою системою за допомогою механичних і електричних сил, то взаємодія називається механічною. Взаємодія, яка наводить до зміни енергії і здійснюється у формі передачі теплоти за допомогою теплопровідності або теплової радіації, називається тепловою. Взаємодія, що призводить до зміни енергії і здійснюється у формі передачі маси, називається массообмінною.
Розрізняють рівноважні і неравноважні процеси.
Рівноважним процесом називається термодинамічний процес, який предсталяє собою безперервну послідовність рівноважних станів. У такому процесі фізичні параметри змінюються нескінченно повільно, так що система весь час знаходиться в рівноважному стані. Крім того, всі частини системи мають однакову температуру і тиск. Рівноважні процеси - оборотні. Оборотні термодинамічні процеси - це такі, за яких термодинамічна система після низки змін свого стану повертається до початкового. Зіставленням необоротних процесів з оборотними можна виявити шляхи підвищення ефективності перших (наприклад, ККД теплових двигунів).
Оборотний термодинамічний процес, в якому робоче тіло, повертаючись у вихідний стан, не набуває двічі одного і того ж стану, називається круговим прогресом, або циклом
Нерівноважним процесом називається термодинамічний процес, який представляє собою послідовність станів, серед яких не всі являются рівноважними. У нерівноважному процесі різні частини системи мають різні температури, тиски, щільність, концентрації.
Стан робочого тіла, коли в кожний момент часу параметри тілі однакові по всій товщі називається рівноважним
Процеси, що протікають в прямому (розширення) І зворотно (стиск) напрямах, проходячи через одні й ті самі проміжні стан в протилежній послідовності, називаються оборотними. При цьому в результаті проведення оборотного процесу як робоче тіло, так і навколишнє середовище повинні повернутися в початковий стан без будь-яких змін. Умови оборотності процесів такі: механічна рівновага, термічна рівновага, відсутність тертя.
Дійсні процеси нерівноважні (протікають з певними швидкостями й з великою різницею температур) і відбуваються при наявності тертя – необоротні.
Види термодинамічних процесів:
Ізохорний процес: — це термодинамічний процес, який відбувається при сталому об'ємі.
Ізобарний процес: зміна стану фізичної системи за сталого тиску.
Ізотермі́чний процес — це термодинамічний процес, який відбувається при сталій температурі.
Адіабатний процес - термодинамічний процес, який відбувається у системі за її повної ізоляції, тобто коли між системою та навколишнім середовищем відсутній теплообмін.
Політропний процес — термодинамічний процес, під час якого питома теплоємність c з газу залишається незмінною
Основні газові закони
Основні газові закони( для ідеальних газів):
1. Бойля-Маріотта
 (4.6)
при сталій температурі питомий об’єм
ідеального газу змінюється обернено
пропорційно, а густина – прямо пропорційно
зміні тиску газу.
(4.6)
при сталій температурі питомий об’єм
ідеального газу змінюється обернено
пропорційно, а густина – прямо пропорційно
зміні тиску газу.
2. Гей-Люссака
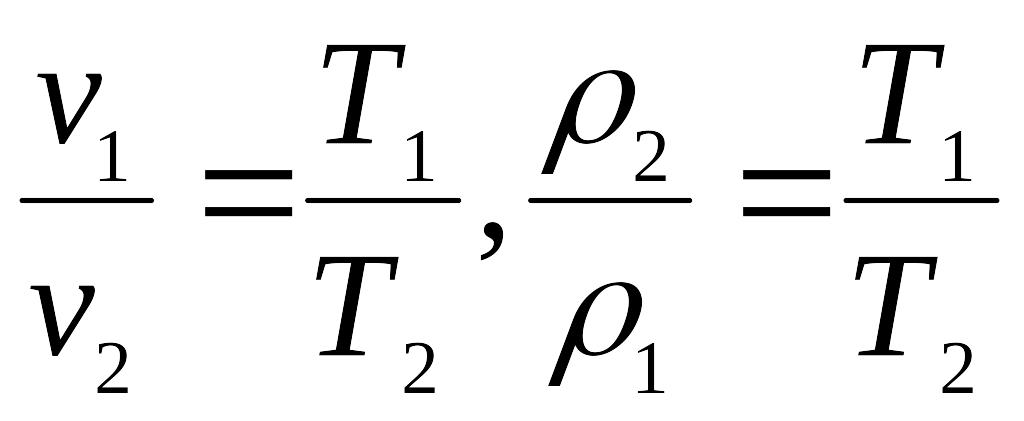 (4.7)
при сталому тиску питомий об’єм
ідеального газу змінюється прямо
пропорційно, а густина – обернено
пропорційно абсолютній температурі
газу.
(4.7)
при сталому тиску питомий об’єм
ідеального газу змінюється прямо
пропорційно, а густина – обернено
пропорційно абсолютній температурі
газу.
3. Шарля
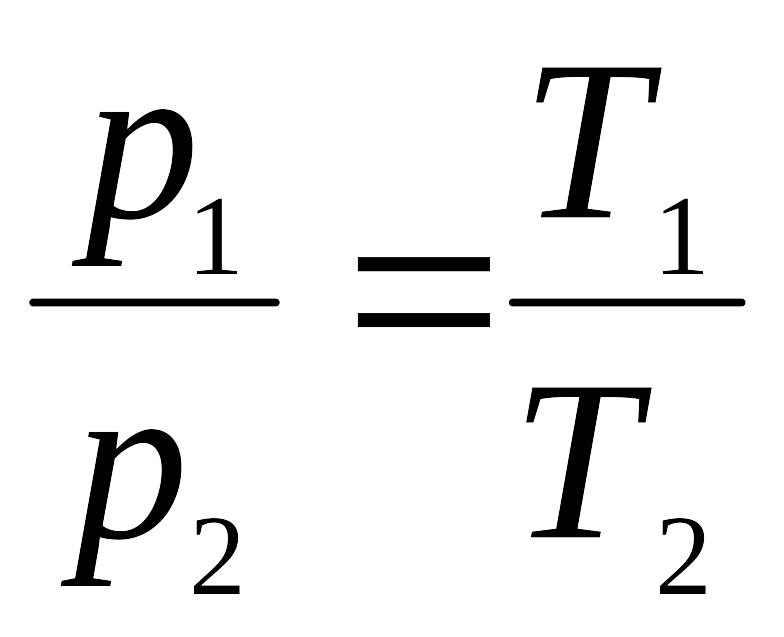 (4.8)
при сталому об’ємі тиск ідеального
газу змінюється прямо пропорційно зміні
абсолютної температури
(4.8)
при сталому об’ємі тиск ідеального
газу змінюється прямо пропорційно зміні
абсолютної температури
4. Авогадро
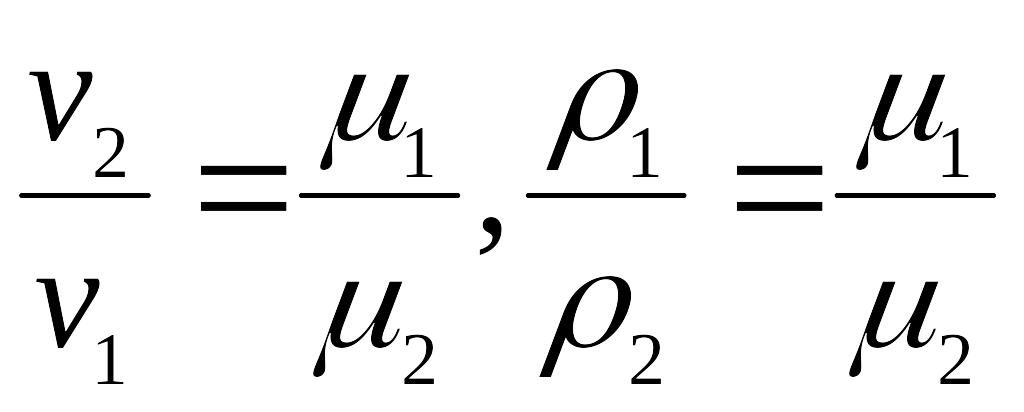 (4.9)
при однакових тисках і температурах
густина газів прямо пропорційна а
питомий об’єм обернено пропорційний
молекулярній масі цих газів.
(4.9)
при однакових тисках і температурах
густина газів прямо пропорційна а
питомий об’єм обернено пропорційний
молекулярній масі цих газів.
Виведення термічного рівняння стану ідеального газу:
Об’єднаний закон Бойля-Маріотта та Гей-Люссака:
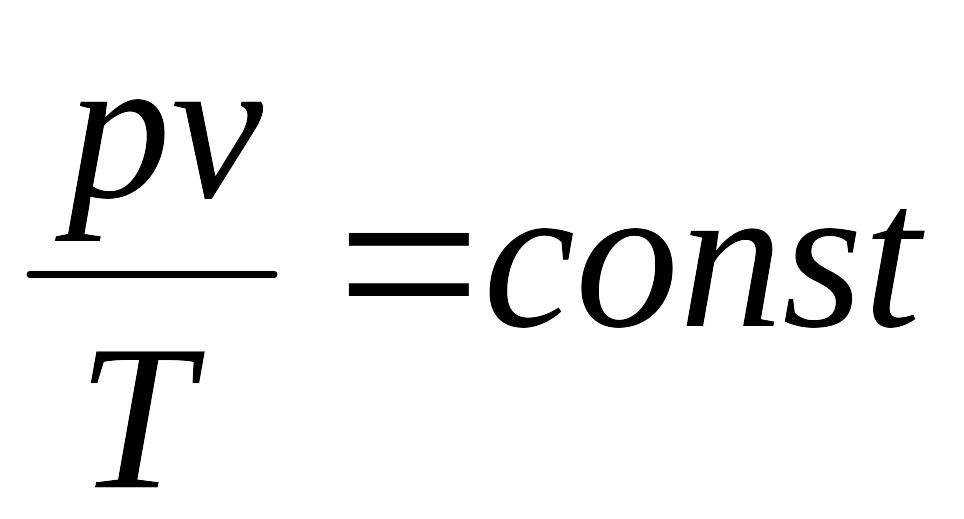 (4.10)- для ідеального газу в різних його
станах добуток тиску на питомий об’єм,
поділений на температуру – величина
стала, яка називається газовою сталою
const=R
(4.10)- для ідеального газу в різних його
станах добуток тиску на питомий об’єм,
поділений на температуру – величина
стала, яка називається газовою сталою
const=R

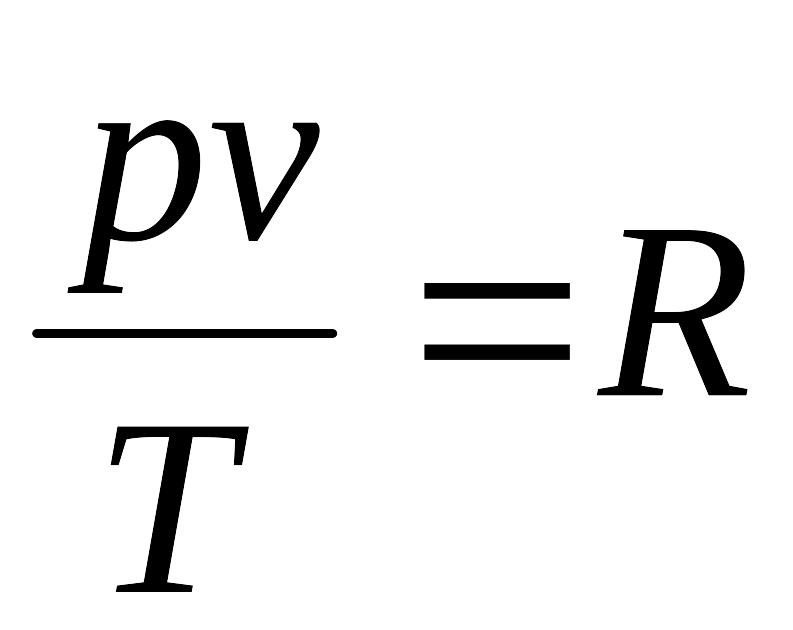
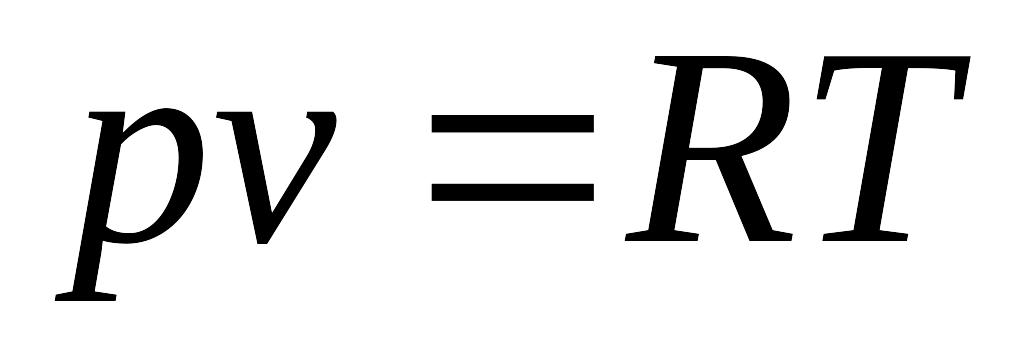 (4.11)- питоме рівняння стану або
характеристичне рівняння Клапейрона
для 1 кг газу; де R – питома газова стала.
(4.11)- питоме рівняння стану або
характеристичне рівняння Клапейрона
для 1 кг газу; де R – питома газова стала.
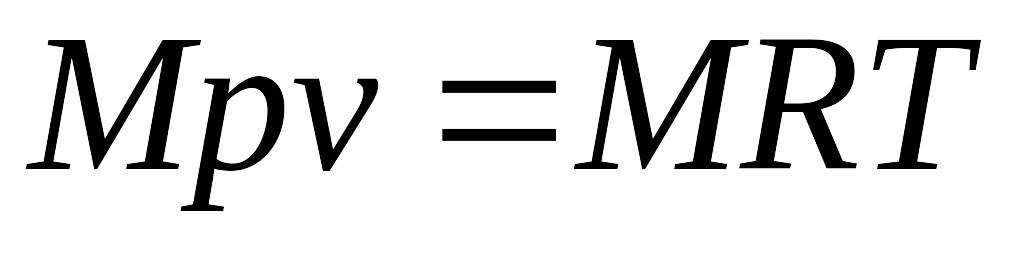 (4.12), де М – маса газу
(4.12), де М – маса газу
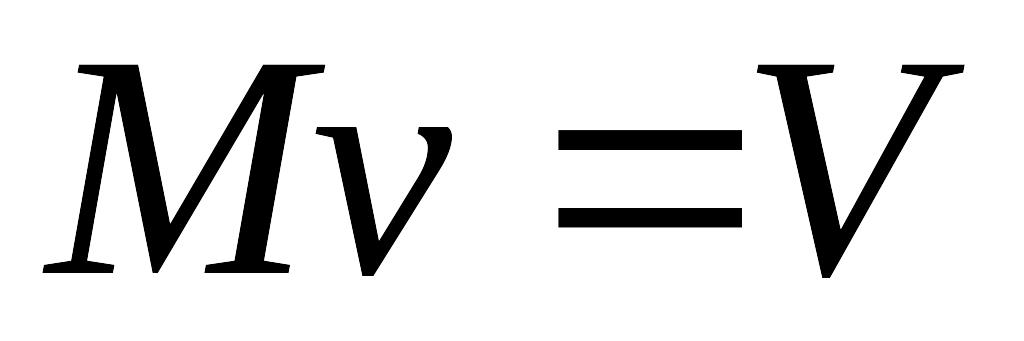 (4.13)
(4.13)
![]() (4.14) - рівняння
стану, або характеристичне рівняння
Клапейрона-Менделєєва для будь-якої
кількості (маси М, кг) ідеального газу.
(4.14) - рівняння
стану, або характеристичне рівняння
Клапейрона-Менделєєва для будь-якої
кількості (маси М, кг) ідеального газу.
р-Н/м2, v i V – м3/кг і м3, М-кг, R – Дж/кг К
Термічне рівняння
стану для реальних газів (Ван дер
Ваальса):
![]() (4.15)
(4.15)
де а, b – коефіцієнти, що мають певне числове значення для різних газів
