
- •Поликлиническая хирургия
- •Часть I общие вопросы поликлинической хирургии
- •Глава 1 организация работы хирургического кабинета (отделения) поликлиники
- •Структура хирургического отделения поликлиники
- •Помещения хирургического отделения поликлиники
- •Глава 2 экспертиза трудоспособности хирургических больных
- •Раздел 1
- •Раздел 2
- •Раздел 3
- •Раздел 4
- •Раздел 5
- •Раздел 6
- •Раздел 7
- •Раздел 8
- •Ориентировочные сроки временной нетрудоспособности при некоторых инфекционных и паразитарных болезнях (класс I по мкб-10)
- •Ориентировочные сроки временной нетрудоспособности при болезнях эндокринной системы, расстройствах питания и нарушениях обмена веществ (класс IV по мкб-10)
- •Ориентировочные сроки временной нетрудоспособности при травмах, отравлениях и других последствиях воздействия внешних причин (класс XIX по мкб-10)
- •Тестовые вопросы
- •9. Ко второй группе инвалидности относятся:
- •10. К третей группе инвалидности относятся:
- •Глава 3 диспансеризация
- •Диспансеризация больных с повреждениями опорно-двигательного аппарата
- •Глава 4 возможности лазерной хирургии в амбулаторных условиях
- •Глава 5 ошибки, опасности, осложнения
- •Глава 6 деонтология в амбулаторной хирургии
- •Часть II частные вопросы поликлинической хирургии
- •Глава 7 обезболивание в амбулаторных условиях
- •Глава 8 острая травма
- •Травма головы
- •Тестовые вопросы
- •Глава 9 общие принципы лечения гнойной инфекции в хирургии
- •Глава 10 острая гнойная инфекция кожи, подкожной клетчатки, мягких тканей
- •Тестовые вопросы
- •Глава 11 болезни периферических сосудов
- •Тестовые вопросы
- •Глава 12 заболевания органов брюшной полости, послеоперационные синдромы, реабилитация после операций
- •Тестовые вопросы
- •Глава 13 заболевания прямой кишки
- •Тестовые вопросы
- •Глава 14 заболевания опорно-двигательного аппарата
- •Тестовые вопросы
- •Глава 15 новообразования
- •Тестовые вопросы
- •115. Женщина 40 лет обратилась по поводу недавно развившегося изъязвления бородавки на подошве. Бородавка существовала с детства, в остальном женщина здорова. Наиболее подходящим будет:
- •Глава 16 болезни придатков кожи
- •1. Вмешательства на мягких тканях
- •2. Операции на ногтевой пластинке
- •3. Операции на ногте и мягких тканях
- •3. Пластические операции
- •Глава 17 проблемы трансплантологии в практике работы хирурга поликлиники
- •Глава 18 проблемы хирургической эндокринологии в практике работы хирурга поликлиники
- •Поликлиническая хирургия практическое руководство
- •167001. Сыктывкар, Октябрьский пр., 55.
Глава 17 проблемы трансплантологии в практике работы хирурга поликлиники
Для практической амбулаторной сети проблема трансплантологии, особенно в далеких от трансплантологических центров регионах, представляется весьма туманной. Однако прогресс науки остановить невозможно, в зарубежных странах пересадка органов превращается в рутинную операцию, совсем недалеко время, когда и в нашей стране пересадки органов перейдут из НИИ и вузовских клиник в практическое здравоохранение. Поликлинические хирурги должны четко представлять возможности лечения некоторых тяжелых заболеваний методами пересадки органов и не отнимать надежду на продление жизни, а иногда и на выздоровление (но с пожизненным приемом иммуносупрессивных средств и иммунологическим мониторингом) у безнадежных больных.
Автору много раз приходилось сталкиваться со смертью пациентов. К сожалению, все люди смертны, но каждый раз со смертью больных уходила в небытие частица собственной души. Особенно, когда умирали молодые и нестарые люди. Всего два примера: молодая девушка с врожденным диабетом, рано ослепшая и умершая от диабетической нефропатии и мужчина 56 лет тоже с инсулинозависимым сахарным диабетом, длительно лечившийся с диабетической стопой, потерявший пальцы и половину обеих стоп, но вылечивший их, почти потерявший зрение, многократно подвергавшийся лазерной коагуляции сетчатки, и длительно и мучительно умиравший от нефропатии и ХПН, но очень хотевший жить, полный творческих планов (вел музыкальную передачу на радио, имел богатейшую фонотеку) и не понимавший, что дни его сочтены.
Не все методы лечения были исчерпаны у этих больных. В настоящее время таким пациентам проводится одновременная пересадка поджелудочной железы и почки. А молодых больных надо лечить намного раньше, выполняя пересадку поджелудочной железы еще до развития грозных осложнений, либо вводя культуры островковых клеток поджелудочной железы. Однако такие случаи для регионов уникальны. Хирурги поликлиник не владеют ситуацией. У больных и их родственников нет информации о возможных методах лечения. Данная глава освещает практические вопросы трансплантологии.
Сегодня в стране более 20 трансплантологических центров. В литературе появилась информация, что донорские органы остаются невостребованными. Ю.Л. Шевченко и соавторы (2000 г.) сообщают, что «… только по Санкт-Петербургу в 1997 г. остались невостребованными более 80 сердечно-легочных и печеночных органных трансплантатов, не говоря о тканевых трансплантатах». Дело остается за подбором пациентов на трансплантацию и финансированием операций. Необходимо отметить, что окончательное решение о пересадке органов и тканей принимают узкие специалисты, которые всесторонне обследуют и лечат больных в профильных отделениях: кардиологии (пересадка сердца), гастроэнтерологии (пересадка печени), нефрологии (пересадка почки), пульмонологии (пересадка легкого или легких, или сердца-легких – на стыке кардиологии и пульмонологии), эндокринологии (поджелудочная железа), но знать показания и противопоказания к трансплантации тех или иных органов и систем, направить на обследование к соответствующему специалисту, информировать больного о возможностях метода, показать пути практической реализации принятого больным решения (для иногородних существует квота региона в Министерстве здравоохранения), знать течение посттрансплантационного периода, иммуносупрессивную терапию и иммунологический мониторинг должен хирург поликлиники. Эта книга адресована молодым хирургам, поэтому хотелось бы, чтобы они использовали все возможности современной хирургии для лечения больных. В данной главе освещаются вопросы подбора пар «донор-реципиент», синдромы отторжения, иммунологическая супрессия, показания, противопоказания к пересадке органов, отдельные технические стороны трансплантации.
ПОДБОР ПАР «ДОНОР-РЕЦИПИЕНТ». Роль иммунной системы в исходе пересадки органов и тканей имеет решающее значение. Решающими для приживления трансплантата являются антигены гистосовместимости групп крови АВО, резус-фактора и антигены гистосовместимости лейкоцитов НLА (эйч-эль-эй). Главный комплекс гистосовместимости (ГКГС) находится в 6-ой хромосоме человека, он включает множество генов, число которых точно не установлено. Определение групп крови, резус-фактора и свойственных им антигенов АВО и Rh не вызывает трудностей. НLА-антигены, расположенные на поверхности клеток, могут быть определены с помощью серологических методов исследования, при которых используют сыворотки, содержащие антитела против специфических антигенов гистосовместимости. Практическое значение имеет определение НLА-А,В,С,Д, в том числе ДR антигенов.

Рис. 68. Схема строения HLA
Основное правило, обеспечивающее безусловный успех пересадки – выбор донора, идентичного с реципиентом по НLА-антигенам. С иммуногенетических позиций можно выделить несколько групп, в которых вероятность идентичности по НLА-антигенам будет резко различаться: 1) При пересадке между сиблингами, т.е. между индивидуумами, состоящими в степени родства «брат-брат» и т.п., вероятность идентичности очень высока, так как у детей одних родителей вероятность наличия одинаковых гомологичных хромосом очень значительная, 2) При пересадке в комбинации «родитель-ребенок» эта вероятность значительно ниже, так как ребенок получает от родителей разный набор антигенов, 3) При пересадке между индивидуумами, не связанными кровным родством, вероятность идентичности по НLА-антигенам очень мала. Приживление трансплантированного органа зависит в основном от степени идентичности антигенов НLА-А и НLА-В, а также, но в меньшей степени от НLА-С, ДR. Выявляют в крови реципиента титр предшествующих антител, их повышение более 50% является прогностически неблагоприятным признаком. Проводят перекрестную пробу – определение наличия НLА-антител в сыворотках потенциальных реципиентов по отношению к лимфоцитам предполагаемых доноров. Совместимость считается хорошей, если имеется совпадение по группе крови, резус-фактору, наличие не менее трех общих антигенов системы НLА-А,В локусов, низкий индекс стимуляции при реакции смешанной культуры лимфоцитов. После определения показаний к пересадке органа образец крови реципиента направляется в центр трансплантологии (если пациент иногородний) для подбора донорского органа с последующим вызовом реципиента в центр.
Важным этапом в оценке донора является проведение антропометрической совместимости донора и реципиента. При решении вопроса о трансплантации комплекса сердце-легкие или легких, печени наружные размеры донора должны быть на 2-3 см, объемные на 10-20% меньше, чем у реципиента. Вес донора должен быть меньше веса реципиента не более чем на 20%, в противном случае большая разница в весе может сказаться на производительности насосной функции сердца.
ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИЗОВ ОТТОРЖЕНИЯ. Несмотря на успехи, достигнутые в трансплантологии и иммуносупрессивной терапии, отторжение остается одной из основных причин гибели пересаженных органов и нередко самого пациента. Вне зависимости от того, какой орган был пересажен, по характеру этиопатогенеза и ответной иммунной реакции можно выделить:
– сверхострое отторжение, развивающееся нередко уже в операционной, как только донорский орган включается в общий кровоток реципиента. Это отторжение обусловлено наличием антител у реципиента, направленных против антигенов донора, и чаще всего требует немедленного удаления пересаженного органа. Ведущая роль в этиопатогенезе сверхострого отторжения отводится гуморальным механизмам иммунного ответа;
– острое отторжение – криз (или эпизод отторжения) развивается в первые дни, недели и месяцы послеоперационного периода и является результатом формирования реакции иммунологического распознавания и клеточно-опосредованного ответа реципиента на тканевые антигены донора;
– хроническое отторжение характерно для более позднего периода, течет медленно и отличается специфическими изменениями, связанными с видом пересаженного органа. Хронические отторжение почек характеризуется артериитом или гломерулонефритом, хроническое отторжение сердца у больных с ишемической болезнью нередко сопровождается поражением коронарных артерий.
При выявлении напряженности трансплантационного иммунитета без явных клинических проявлений нарушения функции пересаженного органа можно говорить о субклинической форме криза отторжения, нередко лежащей в основе хронических структурных нарушений.
Первые попытки подавления реакции отторжения пересаженного органа путем тотального облучения тела реципиента после трансплантации были предприняты в различных клиниках между 1959 и 1962 гг. С 1961 г. цитостатик азатиоприн (имуран) стал применяться при трансплантации почки и способствовал в ряде случаев приживлению трансплантата. Начиная с 1963 г., использование имурана в комбинации с преднизолоном стало стандартным режимом иммуносупрессии после трансплантации почек и печени. Комбинированная иммуносупрессия в сочетании с тщательным подбором пар «донор-реципиент» по лейкоцитарным антигенам системы НLА обеспечила значительное улучшение результатов органных трансплантаций.
Но до начала 80-х годов прошлого века развитие клинической трансплантологии в мире значительно сдерживалось отсутствием высокоэффективных и нетоксичных препаратов иммуносупрессивного ряда. Открытие и внедрение в клиническую практику циклоспорина А с 1978 года резко снизило кризы отторжения, показатели годичной выживаемости трансплантатов увеличились на 20-30%, это послужило мощным толчком к внедрению трансплантации органов в клиническую практику.
Основой современной иммуносупрессивной терапии является «триплет-схема», включающая циклоспорин А, снижение дозы азатиоприна и глюкокортикоидов. Пациенты применяют препараты «триплет-схемы» пожизненно. Для лечения кризов отторжения используют пульс-терапию мегадозами глюкокортикоидов (преднизолон до 1500 мг/сут. в течение 2-3 дней), антилимфоцитарную сыворотку, препараты моноклональных антител к панТ и Т3-лимфоцитам (ортоклон ОКТЗ, мурамонаб и др.). Продолжается активный поиск принципиально новых препаратов (циклоспорин обладает выраженной нефротоксичностью) и схем иммуносупрессивной терапии для увеличения надежности профилактики кризов отторжения, снижения токсичности и выраженности побочных эффектов препаратов «триплет-схемы», снижения инфекционных и опухолевых осложнений в организме реципиента.
Для разрешения иммунологических проблем пересадки органов при центрах трансплантации организуются лаборатории клинической иммунологии и иммунологического типирования тканей, проводится иммунологический мониторинг больных после трансплантации органов.
Иммунологическое типирование доноров производится в лабораториях клинической иммунологии лечебно-профилактических учреждений и лабораториях иммунологического типирования станций переливания крови на основании договора между последними и бригадой по забору и заготовке органов.
ТРАНСПЛАНТАЦИЯ СЕРДЦА
При обсуждении показаний к трансплантации решается круг общемедицинских и социальных аспектов, который выходит за рамки медицинских проблем и решается коллегиально трансплантационным консилиумом врачей, в который входят хирург-трансплантолог, кардиолог, гепатолог, нефролог (соответственно профилю заболевания), иммунолог-клиницист, психиатр и др. Консилиум решает вопросы:
– действительно ли у пациента конечная стадия заболевания и какова продолжительность его жизни;
– существует ли для больного альтернатива трансплантации;
– переносима ли пациентом операция пересадки органа;
– позволяет ли состояние других органов пациента после пересадки пожизненно принимать иммуносупрессанты;
– может ли реципиенту быть гарантировано приемлемое качество жизни;
– подготовлен ли больной психологически к трансплантации и сохранит ли он после нее эмоциональную устойчивость, контактность и интегральность личности.
Консилиум обязан не только изучить данные обследования, но проследить их динамику, а также составить представление о складе характера больного, его доминирующих интересах, поведенческом стереотипе и вредных привычках, о ближайшем окружении и семье. Алкоголизм и употребление наркотиков исключают возможность трансплантации, т.к. делают поведение индивидуума безответственным и непредсказуемым.
Показания и критерии к операции трансплантации сердца:
– ишемическая болезнь сердца в терминальной стадии развития болезни, кардиопатия, клапанные и врожденные пороки сердца с сердечной недостаточностью 4 степени по классификации Нью-Йоркской ассоциации кардиологов с выживанием пациента не менее 6 месяцев;
– нормальная функция или обратимая дисфункция печени и почек;
– легочное сосудистое сопротивление до 3 вудовских единиц;
– возраст больного не старше 50 лет.
Противопоказания к трансплантации сердца:
– активная инфекция;
– злокачественный опухолевый процесс;
– диабет с ретино-, нефро-, ангиопатией;
– легочно-обструктивная болезнь, легочная гипертензия выраженной степени;
– кахексия с асцитом;
– психические заболевания;
– алкоголизм, наркомания;
– психологическая неуравновешенность, нестабильность.
В качестве донора для пересадки сердца должен быть подобран человек не старше 35 лет со здоровым сердцем, с клинически установленной смертью мозга. Если донор после ДТП, следует быть внимательным, так как контузия сердца может быть незамеченной и работа сердца после операции будет неэффективной. Помимо травмы абсолютными противопоказаниями к использованию донорских органов являются злокачественные новообразования и инфекционные заболевания: туберкулез, сифилис, гепатит, СПИД, цитомегаловирусная инфекция.
Пересадку сердца выполняют только в отделениях сердечной хирургии, имеющих опыт проведения искусственного кровообращения, подготовленный квалифицированный персонал. Обычно одновременно в смежных операционных начинают операцию изъятия сердца у донора и подготовку реципиента – удаление больного сердца для того, чтобы максимально сократить время между изъятием и трансплантацией донорского сердца. Выполняются ортотопическая и гетеротопическая пересадка сердца. В течение первого года после операции выживают 80% больных, после 5 лет – 50%. Фармакологическую иммунодепрессию после трансплантации сердца производят теми же препаратами, дозировка подбирается индивидуально. Реакция отторжения проявляется низкими зубцами QR на ЭКГ. Для выявления ранних признаков отторжения используют чрезвенозную эндокардиальную биопсию миокарда с последующим изучением его гистологической структуры.
ТРАНСПЛАНТАЦИЯ ЛЕГКОГО
В настоящее время трансплантация одного или двух легких применяется намного реже, чем почек, сердца, печени. Это связано с большим количеством осложнений в связи с проблемой эффективного осуществления дыхательной функции в раннем послеоперационном периоде, ишемией бронхиального анастомоза из-за разрыва сети бронхиальных сосудов, повышенного риска инфицирования вследствие естественного тесного контакта с окружающей средой, трудностями подбора донора со здоровыми легкими.
Критерии отбора больных для пересадки легких:
– прогрессирующая недостаточность внешнего дыхания (терминальная стадия заболеваний легких) с ожидаемой продолжительностью жизни 12-18 месяцев;
– кислородная зависимости больного (ингаляция или вентиляция);
– нормальная функция сердца;
– отсутствие системных заболеваний;
– отсутствие активной (внелегочной) инфекции;
– отсутствие противопоказаний для иммунодепрессивной терапии;
– возможность в течение месяца (или больше) до операции обходиться без кортикостероидов.
Трансплантация обоих легких чаще производится при эмфиземе, муковисцидозе, цистофиброзе, бронхоэктатической болезни. Односторонняя пересадка чаще выполняется при фиброзирующем альвеолите, первичной легочной гипертензии при отсутствии правожелудочковой недостаточности. Используется преимущественно ортотопическая техника пересадки. Выживаемость к концу 1-го года жизни составляет 65-73%.
ТРАНСПЛАНТАЦИЯ СЕРДЦЕ-ЛЕГКИЕ
Пересадка сердца и легких одним блоком применяется у пациентов с легочной гипертензией первичного и вторичного происхождения и при «легочном сердце», являющимся исходом различных заболеваний легочной (альвеолярной) паренхимы, межуточной ткани или воздухоносных путей:
– заболевания сердца (синдром Эйзенменгера, клапанные пороки с фиксированной легочной гипертензией и недостаточностью правого сердца);
– легочно-васкулярная болезнь (первичная легочная гипертензия, тромбоэмболическая болезнь легких, идиопатический легочный гемосидероз);
– заболевания паренхимы легких с развитием «легочного сердца» (эмфизема, муковисцидоз, фиброзирующий альвеолит, лимфоангиолейомиоматоз легких, альфа-I-антитрипсиновый дефицит);
– заболевания воздухоносных путей с развитием «легочного сердца» (облитерирующий бронхиолит, хронический обструктивный бронхит, цистофиброз легких, фиброз легких, бронхоэктатическая болезнь).
Показания к трансплантации сердца и легких:
– конечная стадия сердечнолегочного заболевания (4 класс NУНА);
– максимальная «естественная» выживаемость менее 12-24 месяцев;
– сохранение функции печени и почек;
– возраст не старше 45 лет.
Противопоказания к трансплантации сердца и легких:
– активная (внелегочная) инфекция, сепсис;
– системные заболевания (диабет, опухоль, коллагеноз и т.д.);
– язвенная болезнь в стадии обострения;
– кахексия с потерей мышечной массы;
– некоррегируемый геморрагический диатез;
– множественная лекарственная аллергия;
– постоянная гормональная зависимость;
– предшествующая операция со вскрытием плевры;
– спаечный процесс в плевре.
Технически операция пересадки легкого и сердца-легкого хорошо разработана. В послеоперационном периоде наблюдается нарушение выделения мокроты в связи с потерей бронхиальной иннервации и легочных рефлексов, высок риск развития отека легких, число инфекционных осложнений после операции более чем в 3 раза превышает таковое при трансплантации сердца, что отражается на уровне смертности больных. Осложнения обусловлены пневмонией, полученной от донора, и цитомегаловирусной инфекцией. Особенности консервации легких заключаются в том, что они предрасположены к более раннему предсмертному повреждению у донора, чем другие органы. Отторжение легких происходит по 3 типам: классическому, атипичному, сосудистому. При классическом отторжении происходит уменьшение перфузии и вентиляции трансплантата, при атипичном – уменьшение альвеолярной вентиляции без изменения перфузии, при сосудистом – снижение перфузии без изменения вентиляции. Для успешного ведения больного в течение первых 24 часов необходимо наличие у постели больного одновременно 2-х медицинских сестер. Большинство реципиентов переносят 2 или 3 значительных криза в первые 3 недели после трансплантации. Все эпизоды острого отторжения проходят в первые 6 недель. Терапия криза отторжения трансплантата включает 3-х дневную пульс-терапию метилпреднизолоном 1000 мг в сутки внутривенно, увеличение дозы циклоспорина, ОКТ-3.
ТРАНСПЛАНТАЦИЯ ПОЧКИ
Исторически почка стала первым органом, пересадки которого были осуществлены в эксперименте, а затем и в клинике. В настоящее время в мире зарегистрировано около 600 центров трансплантации почки, в которых выполнено около 400 тысяч операций. Годичная выживаемость трансплантатов в ведущих клиниках достигает 92-95%, а наибольший срок выживания с пересаженной почкой составляет более 30 лет.
Основным показанием к трансплантации почки является терминальная стадия хронической почечной недостаточности (ХПН). Наиболее часто к ХПН приводят:
– хронический гломерулонефрит;
– хронический пиелонефрит;
– сахарный диабет, поликистоз;
– системные заболевания (склеродермия, системная красная волчанка);
– лекарственные и токсические нефропатии;
– травмы и опухоли (гипернефрома, опухоль Вильмса), по поводу которых необходима нефрэктомия.
Частота вновь выявленных случаев терминальной ХПН составляет 30-50 случаев на 1 млн. населения в год. Существует несколько методов лечения терминальной ХПН: программный гемодиализ, перитонеальный диализ, но наилучшим образом восстанавливает качество продлеваемой жизни больных и обеспечивает их социальную реабилитацию успешная трансплантация почки. Критерии отбора больных для трансплантации почки в последние годы расширены, показанием к трансплантации является ХПН у пациентов в возрасте до 65-70 лет, у которых нет патологии нижних мочевыводящих путей, активной инфекции, выраженной кахексии, злокачественных опухолей или системных заболеваний в активной фазе. Трансплантация почки также является методом выбора лечения детей, страдающих ХПН.
В большинстве случаев выполняется гетеротопическая пересадка почки, трансплантат помещается в подвздошную область контрлатеральную по отношению к донорской почке. Почечная артерия анастомозируется с внутренней подвздошной артерией реципиента, венозный анастомоз накладывается «конец в бок» с наружной подвздошной веной. Восстановление непрерывности мочевыводящих путей после включения трансплантата в кровоток осуществляется имплантацией мочеточника в дно мочевого пузыря.
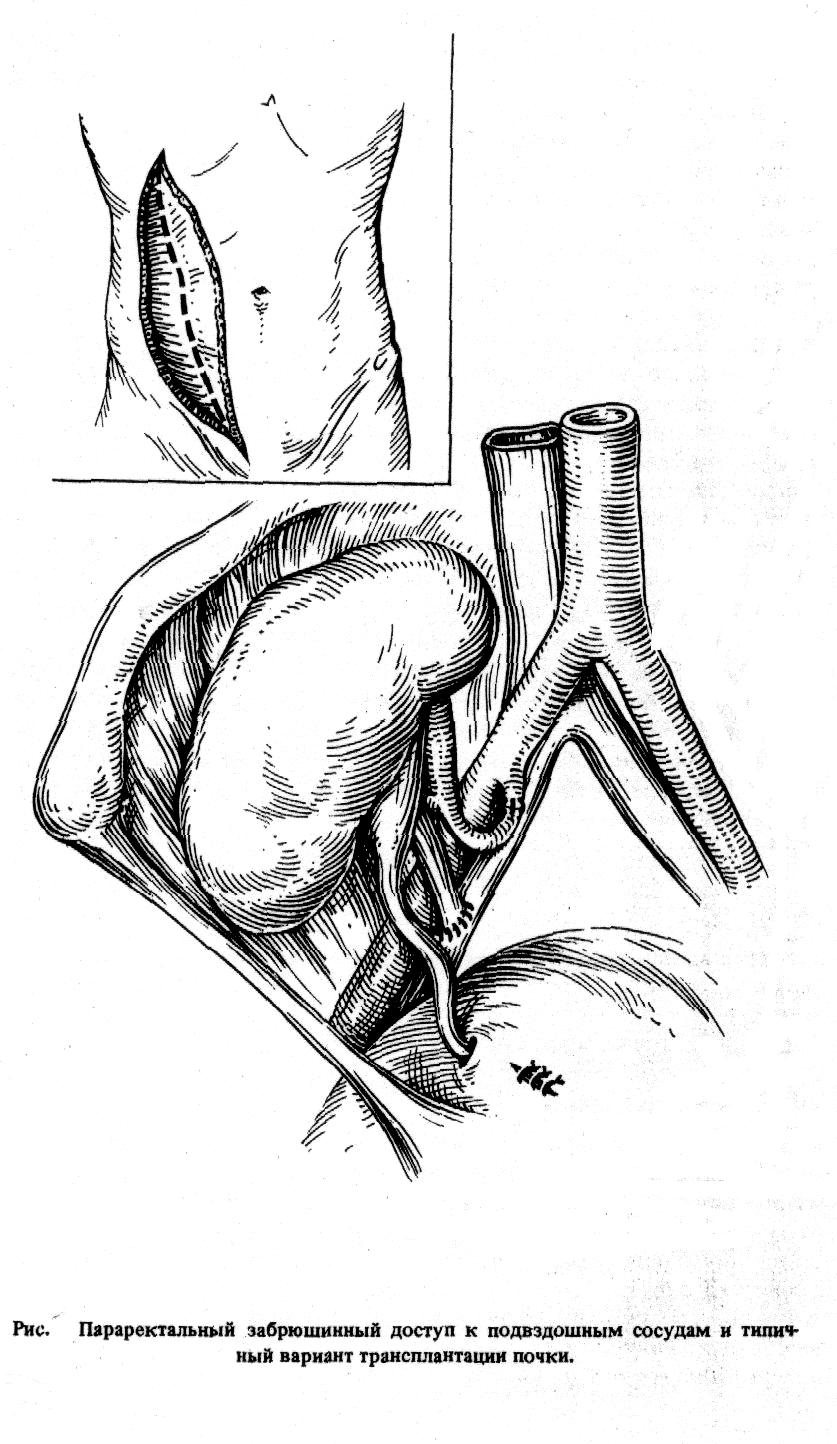
Рис. 69. Параректальный забрюшинный доступ к подвздошным сосудам и типичный вариант трансплантации почки
При пересадке почки от живого родственного донора взятие трансплантата у донора и подготовка сосудов у реципиента должны выполняться двумя бригадами хирургов одновременно в смежных операционных. Почка донора удаляется из раны и ее немедленно начинают перфузировать через артерию охлажденным до 4оС реополиглюкином с добавлением новокаина и 5 мл гепарина. Первичная тепловая ишемия обычно не превышает 2 минуты. Дальнейшие этапы не отличаются от пересадки почки от трупа.
В раннем послеоперационном периоде могут возникнуть осложнения: кровотечение, несостоятельность анастомоза мочеточника с мочевым пузырем и образование мочевых свищей, инфицирование раны и ложа почки, острая недостаточность трансплантата, реакция отторжения трансплантата, инфекционные осложнения мочевых путей; в результате использования иммунодепрессивных препаратов для больного опасны цитомегаловирусная и герпетическая инфекция.
В отдаленном периоде у ряда больных развивается артериальная гипертензия, при неэффективности консервативной терапии приходится выполнять двустороннюю нефрэктомию.
ТРАНСПЛАНТАЦИЯ ПЕЧЕНИ
До 80-х годов прошлого века трансплантология печени прогрессировала крайне медленно, годичная выживаемость больных держалась на уровне 30-35%. Внедрение в клиническую практику циклоспорина А, достижения в области забора и консервации органов, стандартизация самой пересадки создали предпосылки для более широкого внедрения ОТП в клиническую практику. Перечень клинических показаний включает более 50 нозологических форм. У детей наиболее частыми показаниями к ОТП является билиарная атрезия, у взрослых – постнекротический цирроз печени, первичный билиарный цирроз, склерозирующий холангит, метаболические заболевания печени. Показания к ОТП при злокачественных новообразованиях сужены, так как в 80% случаев возникает рецидив.
Перечень абсолютных противопоказаний к ОТП за последние годы уменьшился. Из него исключены серьезные возрастные ограничения, тромбоз воротной вены, предшествующие операции на печени, желчных путях и воротной вене. Абсолютными противопоказаниями к ОТП остаются септические заболевания сердца и легких в терминальной стадии, СПИД. Подбор донорского органа производится с учетом антропометрического соответствия донора и реципиента, совместимости по системе АВО, выполнения прямой перекрестной пробы. Типирование по критериям НLА не имеет решающего значения при пересадке печени, так как взаимосвязи между совместимостью по НLА и отторжением пересаженной печени нет.
Из технических вариантов трансплантации печени гетеротопические методики широкого применения в клинике не нашли, предпочтение отдается ОТП. ОТП – многочасовое хирургическое вмешательство, включающее множество различных элементов, выполнение которых требует максимального внимания и тщательности. ОТП включает 4 основных этапа: 1) извлечение, консервация и подготовка донорского органа, 2) удаление собственной пораженной печени реципиента, 3) имплантация донорской печени, 4) гемостаз. Важное место в проведении операции и профилактике интра- и послеоперационных осложнений отводится порто-кавальному и кава-кавальному шунтированию. Имплантацию донорской печени начинают с наложения верхнего (поддиафрагмального) кавального анастомоза, затем накладывают нижний (подпеченочный) кавальный анастомоз, после – порто-портальный и возобновляют портальный кровоток. Первую порцию крови – около 300-400 мл выпускают в брюшную полость через отверстие в нижнем кавальном анастомозе во избежание рефлекторной остановки сердца при прохождении крови через холодный трансплантат. После заполнения трансплантата портальной кровью и контроля гемостаза обходное кава-кавальное шунтирование прекращают и приступают к наложению артериального анастомоза. До начала билиарной реконструкции необходимо выполнить гемостатические мероприятия. Особенно труден и продолжителен гемостаз раневых поверхностей правого купола диафрагмы и забрюшинной клетчатки, области правого надпочечника. На фоне коагулопатии эти участки плохо поддаются хирургическим методам гемостаза. Восстановление адекватного желчеотделения является завершающим этапом ОТП. Наибольшее распространение получил холедохо-холедохоанастомоз (ХХА) с Т-образным дренажем для беспрепятственного оттока желчи.

Рис. 70. Общий вид пересаженной печени с 4 сосудистыми и одним билиарным аностомозами
Интраоперационные и ранние послеоперационные осложнения: 1) внутрибрюшное кровотечение, 2) тромбоз печеночной артерии трансплантированной печени, 3) несостоятельность швов желчного анастомоза, 4) тромбоз воротной вены, 5) тромбоз нижней полой вены.
Иммуносупрессивную терапию начинают во время операции с введения метилпреднизолона в дозе 0,75-1,5 мг/кг. После операции вводят циклоспорин и азатиоприн. Доза азатиоприна со второй недели уменьшается и к концу 4-ой отменяется. Преднизолон больные получают в течение 3-6 месяцев. Во избежание инфекционных осложнений в течение 5 суток удаляют все дренажи, кроме Т-образного, через 8-12 недель после операции удаляют Т-образный дренаж. Больных выписывают через 4-6 недель после трансплантации. Особое внимание обращают на раннюю диагностику таких симптомов, как ознобы и лихорадка, которые могут быть связаны с холангитом или инфекцией в системе дыхания. После выписки на 2-ой, 4-ой и 8-ой неделе производят общий анализ крови, определяют протромбиновое время, функциональные печеночные пробы и концентрацию циклоспорина.
Реакция отторжения после ОТП бывает 3-х типов: первично-ускоренная, острая (у 70% пациентов первые 3 месяца) и отдаленная. Диагноз криза отторжения ставится на основании динамики желчеотделения, данных биохимического анализа крови, УЗИ и биопсии печени. Для лечения применяют большие дозы метилпреднизилона. Ретрансплантация печени выполняется при отсутствии эффекта от лечения.
К настоящему времени в мире выполнено около 50 тысяч операций ОТП в более чем 200 центрах, годичная выживаемость достигает 80%.
ТРАНСПЛАНТАЦИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Пересадка поджелудочной железы (ПЖ) выполняется при инсулинозависимом сахарном диабете. В целом результаты трансплантации ПЖ уступают результатам пересадки почек, сердца, печени. Органная пересадка ПЖ пациентам с инсулинозависимым сахарным диабетом (ИЗСД) сопряжена с большим риском. В настоящее время ИЗСД страдают в мире более 100 млн. человек. При высокой летальности среди больных ИЗСД эта болезнь не несет непосредственной угрозы жизни, поэтому трансплантацию ПЖ нельзя отнести к разряду операций по жизненным показаниям, кроме больных с ИЗСД в терминальной стадии почечной недостаточности. При необходимости выполняют одновременную пересадку ПЖ и почки. До настоящего времени дискутируется вопрос об органной и сегментарной пересадке ПЖ. Сегментарная пересадка возможна от живого родственного донора, в этом ее преимущество. Ключевым вопросом трансплантации ПЖ является проблема экзокринной (внешней) секреции. Все известные способы хирургической внешнесекреторной функции трансплантата ПЖ можно условно разделить на 2 группы: угнетения секреции и ее сохранения. Интрадуктальное введение быстротвердеющего вещества вызывает блокирование оттока секрета трансплантата ПЖ с последующей атрофией и фиброзным перерождением ацинарных клеток без ухудшения функции островков Лангерганса. Модификацией способа является наружное дренирование ПЖ с последующим через 30-40 дней закрытием протоковой системы. Сохранение внешней секреции ПЖ возможно при инвагинационной панкреатикоеюностомии. Более перспективным является дренирование панкреатического сока в мочевой пузырь путем наложения дуоденоцистоанастомоза или в кишку. ПЖ пересаживают в подвздошную ямку, селезеночные артерию и вену соединяют анастомозами с подвздошными сосудами по типу конец в бок.


Рис. 71. Схема трансплантации сегмента хвоста и тела поджелудочной железы на подвздошные сосуды реципиента с окклюзией панкреатического протока |
Рис. 72. Схема трансплантации комплекса из поджелудочной железы и двенадцатиперстной кишки на подвздошные сосуды с наложением дуоденоцистоанастомоза |
ПЕРСПЕКТИВЫ РАЗВИТИЯ ТРАНСПЛАНТОЛОГИИ
Трансплантология относится к одной из самых динамично развивающихся областей клинической и экспериментальной медицины. Развитие трансплантологии в РФ зависит от общего состояния развития трансплантологической науки и организации службы. Экономическая ситуация обуславливает дальнейшее развитие отрасли и увеличение числа пересадок органов и тканей. Определенные надежды возлагаются на последние достижения генетики в области клонирования живых организмов и селекции трансгенных животных с определенными, закрепленными в генотипе нужными человеку свойствами тканей. Требуется улучшение консервации трансплантатов, кондиционирования доноров-трупов, так как при дистантном заборе органов необходимо обеспечить длительную жизнеспособность перивитального органа. Обсуждаются проблемы перевода трансплантации органов из вузовской медицины в муниципальную с внедрением трансплантологических операций в работу центров сердечно-сосудистой хирургии, как это сделано во всех развитых странах.
