
9 Билет
Коллигативные свойства растворов
Некоторые физические свойства разбавленных растворов зависят от числа растворенных частиц в растворе, а не от их химического состава. Поскольку такие свойства обусловлены коллективным влиянием растворенных частиц, их принято называть коллигативными - от латинского colligatus, что означает собирать. К числу коллигативных свойств относятся: понижения давления пара над раствором, повышение температуры кипения растворов, понижение температуры замерзания растворов и осмотическое давление.
а) понижение давления пара, над раствором.
В результате испарения над жидкостью образуется пар. Эндотермический - процесс испарения протекает обратимо, одновременно с экзотермическим процессом конденсации. При определенных условиях устанавливается равновесие (ΔG = 0).
{H2O}↔ (H2O)
вода пар
Пар, находящийся в равновесии с жидкостью называется насыщенным. Каждой жидкости присуще определенное давление насыщенного пара. Жидкость закипает, когда давление ее пара становится равным атмосферному. При растворении в жидкости какого-либо нелетучего вещества давление пара растворителя над полученным раствором всегда меньше давления пара чистого растворителя.
1-й закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.

где: P1 - давление насыщенного пара над растворителем,
Р - давление насыщенного пара над раствором,
n1 - число моль растворителя,
n2 - число моль растворенного вещества,
Δ Р = Р1- Р - абсолютное понижение давления па
 -
относительное понижение давления.
-
относительное понижение давления.
В более простом виде:
Р1- Р = Р1· N2
где
 —
мольная
доля растворенного вещества
—
мольная
доля растворенного вещества
Закон Рауля имеет несколько различных формулировок и выражений.
Формулировка 2: понижение давления насыщенного пара растворителя над раствором пропорционально его концентрации.
Формулировка 3: парциальное давление насыщенного пара растворителя над раствором равно давлению насыщенного пара над чистым растворителем, умноженному на мольную долю растворителя в растворе. Преобразуем:
Р1 - Р1· N2 = Р
P = Р1 (1- N2 );
(N1 + N2 =1 , 1-N2 = N1)
P = Р1· N1,
Из закона Рауля следует, что понижения давления пара разбавленного раствора не зависит от природы растворенного вещества, а зависит только от концентрации раствора.
б) повышение температуры кипения и понижение температуры замерзания.
В прямой зависимости от давления насыщенного пара раствора нелетучего вещества находится температура кипения раствора.
Температурой кипения - жидкости является температура, при которой давление ее паров становится равным внешнему давлению (так, при 101 кПа температура кипения воды =100°С, бензола = 80°С).
Понижение давления пара растворителя в результате растворения в нем вещества означает необходимость повышения температуры раствора для восстановления нарушенного равновесия жидкость - пар, чтобы довести давление насыщенного пара до первоначального.
Температура замерзания раствора ниже температуры замерзания растворителя, что также связано с понижением давления пара над раствором.
Температура замерзания (отвердевания, кристаллизации) - это температура, при которой давление пара над жидкостью становится равным давлению пара над твердой фазой.
2-й закон Рауля: понижение температуры замерзания или повышение температуры кипения растворов прямо пропорционально их моляльной концентрации.
Математические выражения:
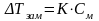
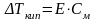
Коэффициенты пропорциональности К и Е называются:
К - криоскопическая константа
Е - эбуллиоскопическая константа -
Коэффициенты К и Е являются характеристиками данного растворителя и показывают понижение температуры замерзания или повышение температуры кипения вызываемое растворением 1 моль вещества в 1 кг этого растворителя. Величины табличные для каждого растворителя.
Из уравнения при См = 1 моль/кг:
![]() Так,
если
растворить 1моль NaCI
в 1 кг воды, то получим:
Так,
если
растворить 1моль NaCI
в 1 кг воды, то получим:
Метод исследования, основанный на измерении понижения температуры замерзания растворов, называется криоскопией.
Метод, основанный на измерении повышения температуры кипения растворов - эбуллиоскопией.
Методами криоскопии и эбуллиоскопии определяются молекулярные массы растворенного неэлектролита.
Так, если m2 граммов вещества растворили в m1 растворителя, то моляльная концентрация равна:

в) осмотическое давление
Осмос - самопроизвольная диффузия растворителя через
полупроницаемую мембрану в раствор.
Давление, которое нужно приложить к раствору, чтобы прекратить осмос, называется - осмотическим давлением.
Осмотическое давление в растворах, как установил Вант - Гофф зависит от молярной концентрации раствора, т.е. от числа молекул растворенного вещества в единице объема и от температуры.
π = См • R • Т - уравнение Вант - Гоффа
где:
См - молярная концентрация растворенного вещества,
R - универсальная газовая постоянная,
Т - абсолютная температура.
Так как молярная концентрация равна отношению числа молей растворенного вещества к объему раствора, то можно записать:

Осмотическое давление биологических жидкостей в различных организмах неодинаково, так осмотическое давление у лягушек несколько ниже, чем у человека, а у некоторых морских животных, обитающих в воде со значительным содержанием солей оно выше. Известно, что в тканях растений, всасывающих воду из почвы, осмотическое давление достигает 5-20 атм, а у некоторых растений пустынь и солончаков - даже 170 атм.
Человеческий организм характеризуется большим постоянством ряда физико - химических показателей внутренней среды в том числе осмотическим давлением крови. Кровь, лимфа, тканевые жидкости человека представляют собой водные растворы молекул и ионов многих веществ. Их суммарное осмотическое давление при 37°С составляет 7,7 атм. Такое же давление создает 0,9% (0,15М) раствор NaCI, являющийся изотоничным крови (т.е. обладающий тем же осмотическим давлением, что и кровь), его применяют в качестве кровезаменителя в хирургии и называют физиологическим (раствор поваренной соли с добавками солей и белков).
Изменение осмотического давления оказывается губительным для организма. Понижение осмотического давления путем введения больших избытков воды или в результате интенсивной потери солей, например с потом, вызывает судороги, затемнение сознания и т.д. вплоть до гибели организма. Повышение же осмотического давления введением больших количеств солей приводит к перераспределению воды. Вода скапливается в тех тканях, в которых откладываются избыточные количества солей, что вызывает отеки этих тканей, в то же время обезвоживание слизистых оболочек обусловливает чувство жажды, ведет к нарушению нормальной деятельности нервной системы и других жизненно важных органов.
Росм · V = n2 · R ·T,
т.е. это уравнение совпадает с уравнением состояния идеального газа Менделеева - Клапейрона, что позволило Вант - Гоффу сформулировать свой закон.
Принцип Вант – Гоффа: осмотическое давление разбавленного раствора равно тому газовому давлению, которое производило бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, что и раствор.
Осмос имеет большое значение в процессах жизнедеятельности животных и растений. Он обусловливает поднятие воды по стеблю растения, растительной клетки. Осмотическое давление в клетках обусловливает их своеобразную упругость и эластичность, а также способствует сохранению определенной формы стеблями и листьями растений. Если срезать растение, то вследствие испарения воды объем внутриклеточной жидкости уменьшается, оболочки клеток опадают, становятся дряблыми - растение вянет. Но стоит начавшее вянуть растение поставить в воду, как начинается осмос, оболочки клеток снова напрягаются и растение принимает прежний вид. Каждая живая клетка имеет либо оболочку, либо поверхностный слой протоплазмы, обладающие свойством полупроницаемости.
Стенки растительных и животных клеток представляют собой полупроницаемые перегородки. Постоянно поддерживаемое в них осмотическое давление обуславливает упругость клеток и тканей, так называемый тургор.
Ка́льций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca. Простое вещество кальций — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета.
Получение
Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C:
![]()
Свойства
Физические
Металл
кальций существует в двух аллотропных
модификациях. До 443 °C устойчив α-Ca с
кубической гранецентрированной решеткой
(параметр а =
0,558 нм), выше устойчив β-Ca с кубической
объемно-центрированной решеткой
типа α-Fe (параметр a =
0,448 нм). Стандартная энтальпия ![]() перехода α
→ β составляет 0,93 кДж/моль.
перехода α
→ β составляет 0,93 кДж/моль.
При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является). При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы). Уникальное поведение кальция похоже во многом на стронций (то есть параллели в периодической системе сохраняются).
Химические
Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем более тяжёлых щёлочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло серая, поэтому в лаборатории кальций обычно хранят, как и другие щёлочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
Кроме силицида кальция Ca2Si известны также силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты. Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
![]()
![]()
Ион Ca2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4,ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция СаСО3, кислый карбонат кальция (гидрокарбонат) Са(НСО3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение, а тех же местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция
![]()
Так в природе происходит перенос больших масс веществ. В результате под землей могут образоваться огромные провалы, а в пещерах образуются красивые каменные «сосульки» — сталактиты и сталагмиты.
Наличие в воде растворенного гидрокарбоната кальция во многом определяет временную жёсткость воды. Временной её называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает СаСО3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Применение
Лекарственные средства
Соединения кальция широко применяются в качестве антигистаминного средства.
Хлорид кальция
Глюконат кальция
Глицерофосфат кальция
Кроме того, соединения кальция вводят в состав препаратов для профилактики остеопороза, в витаминные комплексы для беременных и пожилых.
Биологическая роль
Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита[5]. Из различных форм карбоната кальция (извести) состоят "скелеты" большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Концентрация кальция в цитоплазме клеток человека составляет около 10−4 ммоль/л, в межклеточных жидкостях около 2,5 ммоль/л.
Концентрация кальция в крови из-за её важности для большого числа жизненно важных процессов точно регулируется, и при правильном питании и достаточном потреблении обезжиренных молочных продуктов и витамина D дефицита не возникает. Длительный дефицит кальция и/или витамина D в диете приводит к увеличению риска остеопороза, а в младенчестве вызывает рахит.
Избыточные дозы кальция и витамина D могут вызвать гиперкальцемию. Максимальная безопасная доза для взрослых в возрасте от 19 до 50 лет включительно составляет 2500 мг в сутки.
Классификация органических соединений
Вы
уже знаете, что свойства органических
веществ определяются их составом и
химическим строением. Поэтому
неудивительно, что в основе классификации
органических соединений лежит именно
теория строения — теория
А. М. Бутлерова. Классифицируют
органические вещества по наличию и
порядку соединения атомов в их молекулах.
Наиболее прочной и малоизменяемой
частью молекулы органического вещества
является ее скелет — цепь атомов
углерода. В зависимости от порядка
соединения атомов углерода в этой цепи
вещества делятся на ациклические, не
содержащие замкнутых цепей атомов
углерода в молекулах, и карбоциклические,
содержащие такие цепи (циклы) в
молекулах.
Помимо атомов углерода и
водорода, молекулы органических веществ
могут содержать атомы и других химических
элементов. Вещества, в молекулах которых
эти так называемые гетероатомы включены
в замкнутую цепь, относят к гетероциклическим
соединениям.
![]()
Функциональная группа — группа атомов, которая определяет наиболее характерные химические свойства вещества и его принадлежность к определенному классу соединений.
В
молекулах кетонов карбонильная
функциональная группа связана с двумя
атомами углерода, а в молекулах альдегидов
— с одним атомом углерода и
атомом водорода.

Нетрудно заметить, что карбоксильная группа атомов может рассматриваться как объединение других известных вам функциональных групп — карбонильной и гидроксильной —ОН, что делает понятным и происхождение ее названия. Простые эфиры можно рассматривать как продукты замещения атома водорода в гидроксильной группе спиртов на углеводородный радикал. В молекулах этих соединений два углеводородных радикала связаны через оксигруппу —О —, которую часто называют поэтому «кислородным мостиком». Общая формула простых эфиров R1—О—R2.
Сложные эфиры содержат в молекуле функциональную группу атомов, которую так и называют — сложноэфирная. Сложные эфиры можно считать производными карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал, что делает понятными их названия. Нитросоединения содержат в молекуле нитрогруппу —N02, например: СН3—СН2—NO2 нитроэтан Замещая в молекуле аммиака атомы водорода на углеводородные радикалы, можно получить первичные (RNН2), вторичные (R2NH) и третичные (R3N) амины: СН3—NH2 СН3—СН2—NH—СН2—СН3 N(СН2—СН3)3 метиламин диэтиламин триэтиламин В состав молекул органических соединений может входить несколько одинаковых (полифункциональные соединения) или разных (гетерофункциональные соединения) групп. Например, полифункциональным соединением является многоатомный спирт — глицерин. Среди важных гетерофункциональных соединений выделим углеводы (альдегидоспирты и кетоноспирты) и аминокислоты. Строение и свойства соединений этих классов будут рассмотрены ниже.
Карбоциклические (алициклические) соединения Карбоциклическими соединениями называются органические вещества, содержащие в молекуле замкнутую цепь атомов углерода (цикл). Цикл может содержать разное количество атомов углерода, связанных одинарными или кратными связями. Структурные формулы алициклических соединений часто упрощают, указывая лишь химические связи скелета молекулы и функциональные группы, входящие в ее состав:
Следует особо отметить ароматические соединения — арены — разновидность карбоциклических соединений, содержащих в молекуле специфическую систему чередующихся двойных и одинарных связей
Система сопряженных п-связей в цикле обусловливает устойчивость молекул и набор специфических свойств, отличающих их от алифатических соединений с теми же функциональными группами.
Гетероциклические соединения Вам уже известно, что гетероатомы (О, N, S) могут не только входить в состав функциональных групп, но и быть частью замкнутого скелета молекулы — цикла. Такие соединения называют гетероциклическими или гетероциклами.Гетероциклические соединения играют важную роль в биохимических процессах: они входят в состав многих биологически важных веществ — белков и нуклеиновых кислот. Некоторые гетероциклы, например пиридин, как и арены (ароматические карбоциклы), содержат сопряженную систему я-связей и, следовательно, могут быть отнесены к ароматическим соединениям.
Амины
Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атомаводорода замещены на углеводородные радикалы.
По числу замещённых атомов водорода различают соответственно первичные, (Замещен один атом водорода) вторичные (Замещены два атома водорода из трех) и третичные (Замещены три атома водорода из трех) амины.Четвертичное аммониевое соединение вида [R4N]+Cl- является органическим аналогом аммониевой соли.
По характеру органической группы, связанной с азотом, различают алифатические CH3-N<, ароматические C6H5-N< и жирно-ароматические (содержат ароматический и алифатический радикалы) амины.
По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины и так далее.
Номенклатура
К названию органических остатков, связанных с азотом, добавляют слово «амин» при этом группы упоминают в алфавитном порядке: CH3NC3H7 — метилпропиламин, CH3N(C6H5)2 —метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода:
2-аминопентан
Для некоторых аминов используются тривиальные названия: C6H5NH2 — анилин (систематическое название — фениламин).
Химические свойства
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине.
Алкиламины являются сильными основаниями, ариламины менее основны.
Взаимодействие с водой. Водные растворы алифатических аминов проявляют щелочную реакцию, так как при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
Взаимодействуя с кислотами, амины образуют алкиламмониевые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды:
Ацилирование. При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом -С(О)N<:
Реакция с ангидридами протекает в мягких условиях. Ещё легче реагируют хлорангидриды, реакция проводится в присутствии основания, чтобы связать образующийся HCl.
Таким образом получают жаропонижающее средство — ацетанилид:
![]()
Если в качестве исходных соединений взять диамин и дикарбоновую кислоту, то они взаимодействуют по такой же схеме, но поскольку каждое соединение содержит две реагирующие группы, то образуется полиамид.
Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R, которая также эквивалентна уже имеющимся.
Ароматические амины реагируют с галогенами по механизму электрофильного замещения в бензольном ядре. При галогенировании анилина бромной водой комнатной температуре, образуется триброманилин (в виде осадка белого цвета):
![]()
Если нет реакционноспособных групп в радикале, то образуются N-галогенамины.
Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. При помощи азотистой кислоты первичные, вторичные и третичные амины отличают друг от друга. Из первичных аминов образуются первичные спирты:
При этом выделяется газ (азот). Это признак того, что в колбе первичный амин. Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O:
![]()
Вторичные амины сложно не узнать, по лаборатории распространяется характерный запах нитрозодиметиламина.
Третичные амины при обычной температуре в азотистой кислоте просто растворяются. При нагревании возможна реакция с отщеплением алкильных радикалов.
конденсация первичных аминов с альдегидами и кетонами приводит к образованию иминов или так называемых оснований Шиффа — соединений, содержащих фрагмент -N=C<:
При горении амин выделяет кроме воды и углекислого газа ещё и азот:
![]()
[править]Получение
Восстановление нитросоединений — Реакция Зинина. Эту реакцию впервые осуществил Н. Н. Зинин в 1842 году. Действуя на нитробензол сульфидом аммония, он получил анилин:
![]()
Восстановление железом:
![]()
Восстановление водородом в присутствии катализатора и при высокой температуре:
![]()
Также возможно получение путем восстановления нитрилов, оксимов, амидов, путем алкилирования аммиака (реакция Гофмана), путем перегруппировки бензильных четвертичных аммониевых солей (реакция Соммле-Хаузера), путем перегруппировки гидроксамовых кислот (перегруппировка Лоссена).
Вредное воздействие
Амины являются очень токсичными веществами. Опасно как вдыхание их паров, так и контакт с кожей. Амины, например анилин, способны всасываться сквозь кожу в кровь и нарушать функции гемоглобина, что может привести к летальному исходу. Симптомами отравления крови амином являются посинение кончиков пальцев, носа, губ, одышка, учащенные дыхание и сердцебиение, потеря сознания. В случае попадания амина на незащищенные участки кожи необходимо быстро и аккуратно, не увеличивая площадь поражения, очистить пораженный участок кожи ватой, смоченной в спирте. В случае отравления вывести пострадавшего на свежий воздух, обратиться к врачу.
Большинство алкалоидов являются аминами (некоторые амидами).
10-билет
1). Осмос процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворенного вещества (меньшей концентрации растворителя).
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворенных вещ-в. Важным частным случаем осмоса яв-ся осмос через полупрон (имеют достаточно высокую проницаемость не для всех, а для растворителя) мембрану. Подвижность раств. вещ-в в мембране стремится к нулю. Если такая мем-на разделяет чистый растворитель и раствор, то концен-я растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворенного вещ-ва. Растворы достигшие равновесия называются изотоническими. Осмос, направленный внутрь органического объема жидкости, называется эндосмосом, наружу – экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса – обратной диффузии растворителя.
Росм=См*RT, где R -газ пост = 8,31 Дж/моль а T = 273+tC
Осмос играет важную роль во многих биологических процессах. Участвует в переносе питательных вещ-в в стволах деревьев, где капиллярный перенос не способен выполнить эту фун-ю.
Клетки растений используют осмос также для увеличения объема вакуоли, чтобы она распирала стенки клетки (тургоное давление)
Когда 2 раствора с разной концентрацией растворенных вещ-в разделены полупроницаемой мембраной, на нее действует сила, направленная от более разбавленного к более концентрированному раствору. Эта сила, называемая осмотическим давлением. Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нем веществ( или ионов, если молекулы вещ-ва дисссоциируют). Чем больше концентрация раствора, тем больше создаваемое им осмот давление.
Плазмолиз. Плазмолиз (от греч. plásma - вылепленное, оформленное и lýsis - разложение, распад), отставание протопласта от оболочки при погружении клетки в гипертонический раствор. П. характерен главным образом для растительных клеток, имеющих прочную целлюлозную оболочку. Животные клетки при перенесении в гипертонический раствор сжимаются. В зависимости от вязкости протоплазмы, от разницы между осмотическим давлением клетки и внешнего раствора, а следовательно от скорости и степени потери воды протоплазмой, различают П. выпуклый, вогнутый, судорожный и колпачковый. Иногда плазмолизированные клетки остаются живыми; при погружении таких клеток в воду или гипотонический раствор происходит деплазмолиз. Для сравнительной оценки П. в тканях существует 2 метода: пограничного П. и плазмометрический. Первый метод, разработанный Х. Де Фризом (1884), заключается в погружении тканей в растворы с различной концентрацией KNO3, сахарозы или др. осмотически активного вещества и установлении той концентрации, при которой плазмолизируется 50% клеток. При плазмометрическом методе после П. измеряют относительный объём клетки и протопласта и по концентрации раствора вычисляют осмотическое давление клетки (по соответствующим формулам).
Гемо́лиз (греч. haima кровь + lysis распад, разрушение)
разрушение эритроцитов с выходом гемоглобина в окружающую эритроциты среду. В организме постоянно имеет место так называемый физиологический гемолиз вследствие естественного старения эритроцитов. В результате Г. происходит освобождение гемоглобина, который связывается с белками плазмы крови в комплекс гемоглобий — гаптоглобин, затем под воздействием ферментов идет процесс окисления и отщепления гема от молекулы глобина, разрушения гема и образования билирубина.
Продолжительность жизни эритроцитов в среднем колеблется от 100 до 130 дней
Гемо́лиз (haemolysis; гемо- (Гем-) + греч. lysis распад, разрушение; син.: гематолиз — устар., эритроцитолиз)
разрушение эритроцитов с выходом гемоглобина в окружающую эритроциты среду.
Гемо́лиз внутриаппара́тный — Г., происходящий в аппарате искусственного кровообращения во время перфузии.
Гемо́лиз внутрикле́точный — Г., происходящий внутри клеток ретикулоэндотелиальной системы, главным образом в селезенке.
Гемо́лиз внутрисосу́дистый — Г., происходящий в циркулирующей крови.
Гемо́лиз постгепати́тный — Г., возникающий после перенесенного вирусного гепатита в результате появления в крови аутоантител к эритроцитам (гемолизинов).
Изотонический раствор — это 0,9 % раствор натрия хлорида. Его осмотическое давление равно осмотическому давлению крови и тканевых жидкостей (отсюда название «изотонический»). Изотонический раствор натрия хлорида широко используется в практике с различными целями. Его назначают во всех случаях дефицита натрия и хлоридов в организме: при неукротимой рвоте, длительном поносе (холера, диспепсия), обширных ожогах и т. д. При массивной кровопотере и шоке изотонический раствор натрия хлорида иногда вводят с тем, чтобы увеличить массу циркулирующей в сосудах жидкости и таким образом купировать резкое падение артериального давления. Однако действие изотонического раствора в подобных случаях непродолжительно, так как ионы натрия и вода быстро переходят из крови в ткани и энергично выводятся почками. По эффективности при шоке и кровопотерях введение изотонического раствора натрия хлорида уступает переливанию крови и введению противошоковых жидкостей и кровезаменителей.
Очень часто изотонический раствор используется в качестве растворителя лекарственных средств, предназначенных для парентерального введения.В организм изотонический раствор можно вводить любыми путями: внутрь, внутривенно, подкожно, в капельных клизмах.
В отличие от изотонического раствора гипер- и гипотонические растворы оказывают местное воздействие на ткани, которое зависит от разницы осмотического давления этих растворов и осмотического давления в тканях.
4). Альдегиды и кетоны. В молекулах этих соединений содержится двухвалентная карбоксильная группа. В альдегидах она связана с одним атомом Н и с углеводородным радикалом, в кетонах – с двумя углеводородными радикалами. Наличие и в альдегидах, и кетонах карбонильная группа обусловливает определенное сходство их свойств. Однако имеются и различия, связанные с тем, что в молекулах альдегидов одна из связей карбонильной группы затрачивается на соединение с водородом; поэтому они содержат своеобразную альдегидную функциональную группу. За счет водорода этой группы альдегиды очень легко окисляются, превращаясь в карбоновые кислоты. Так, при окислении уксусного альдегида образуется уксусная кислота, которую широко используют в промышленности и быту. Вследствие легкой окисляемости альдегиды яв-ся энергичными восстановителями; этим они существенно отличается от кетонов, которые окисляются значительно труднее. Кетоны в этих условиях не окисляются, поэтому обе реакции используют к качественные, позволяющие отличить альдегиды от кетонов.
11-билет
1) . Давление пара растворителя над раствором. Закон Рауля. Между жидкостью и ее насыщенным паром существует динамическое равновесие
жидкость↔ насыщенный пар,
т.е. число молекул жидкости, испаряющихся с поверхности, равно числу конденсирующихся молекул. Этому равновесию соответствует давление насыщенного пара растворителя над чистым растворителем Нижний индекс (1) обозначает то, что свойство относится к растворителю; (2) – к растворенному веществу, а верхний индекс (о) указывает на то, что это свойство вещества в чистом состоянии; в данном случае это свойство чистого растворителя. В 1882 г. французский ученый Рауль сформулировал закон, названный его именем: давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя:
![]()
Выражение
для молярной массы растворенного
вещества
![]()
Следовательно, измеряя экспериментально давление насыщенного пара растворителя над раствором можно определить молярную массу растворенного вещества.Температура замерзания и кипения растворов. Эбулиоскопия. Криоскопия. Понижение давления насыщенного пара растворителя над раствором приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.
Согласно первому следствию из закона Рауля повышение температуры кипения и понижение температуры замерзания растворов неэлектролитов прямо пропорционально моляльной концентрации растворенного вещества:
ΔТкип.=ЕСm(2)
ΔТзам..=KСm(2)
где Сm(2)Сm(2) – моляльная концентрация раствора; Е - эбулиоскопическая и К – криоскопическая постоянные, соответствующие повышению температуры кипения и понижению температуры замерзания раствора с Сm(2)=1 моль/1000 г растворителя. Значения Е и К зависят только от природы растворителя (табл.7.1).
Согласно второму следствию из закона Рауля: эквимолекулрные количества различных неэлектролитов, растворенные в одинаковых количествах по массе одного и того же растворителя увеличивают температуру кипения или понижают температуру замерзания на одно и то же число градусов. Осмос. Закон Вант-Гоффа. Процесс самопроизвольного перехода растворителя (диффузия) через полупроницаемую мембрану, называемый осмосом. Давление, которое необходимо приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением. Если давление, приложенное к более концентрированному раствору, больше осмотического, то растворитель будет переходить из раствора в растворитель. Процесс носит название обратный осмос и используется для очистки природных и сточных вод, в частности, может быть использован для водоподготовки в теплоэнергетике.Зависимость осмотического давления от температуры и концентрации описывается уравнением:
π = с(В)RT,
где π – осмотическое давление; с(В) – молярная концентрация растворенного вещества, моль/л; R – универсальная газовая постоянная; T – температура, К. Закон Вант-Гоффа: осмотическое давление равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор.
Из закона Вант-Гоффа следует, что растворы различных неэлектролитов одинаковой концентрации, находящиеся при одинаковой температуре являются изотоническими, т.е. имеющими одинаковое осмотическое давление.
Эбулиоскопия (от лат. ebulio — вскипаю) — метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем. Используется для определения молекулярной массы растворенного вещества, активности растворителя, степени диссоциации (или изотонического коэффициента).
Температура кипения жидкости — такая температура, при которой давление пара над жидкостью равно внешнему давлению. В то же время давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и, в соответствии с законом Рауля, может быть выражено уравнением:
![]()
где x1 — мольная доля растворителя.
Видно, что при повышении концентрации растворенного вещества давление пара над раствором будет снижаться, а следовательно, при неизменном внешнем давлении, будет расти температура кипения.
С учетом уравнения Клапейрона — Клаузиуса можно показать[1], что изменение температуры кипения раствора (ΔTboil) может быть рассчитано по формуле:
![]()
где ΔHboil — энтальпия испарения;
M1 — молярная масса растворителя;
n2 — моляльная концентрация растворенного вещества. Дробь в квадратных скобках в этом выражении зависит только от свойств растворителя — это так называемая эбулиоскопическая константа растворителя ε. Она равна повышению температуры кипения одномоляльного раствора. Если известны изменение температуры кипения и концентрация раствора, можно определить молярную массу растворенного вещества:
![]()
где
a — число грамм растворенного вещества
на 1000 г растворителя. Этот метод применим
для разбавленных растворов нелетучих
веществ и неэлектролитов. Эбулиоскопический
метод позволяет судить о состоянии
вещества в растворах электролитов, так
как для последних:
![]()
где i — изотонический коэффициент.
С
помощью эбулиоскопии можно определить
и активность растворителя, в соответствии
с формулой[2]:
![]()
Криоскопия (от греч. κρύο — холод и греч. σκοπέω смотрю) — метод исследования растворов, в основе которого лежит измерение понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя. Был предложен Ф. Раулем в 1882 году.
Давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и может быть выражено уравнением (согласно закону Рауля):
где x1 — мольная доля растворителя.
Видно,
что оно ниже, чем давление пара над
чистым растворителем, и снижается с
ростом концентрации растворенного
вещества.В то же время при замерзании
раствора давление пара над твердой
фазой должно быть равно давлению пара
над жидкостью. Если при замерзании
раствора выделяется чистый растворитель,
то давление пара над жидким раствором
должно быть равно давлению пара над
твердым чистым растворителем. Как было
показано выше, давление пара над
раствором ниже давления пара над чистым
жидким растворителем, а следовательно,
и соответствующее температуре замерзания
равновесие для раствора будет
устанавливаться при меньших температурах,
чем для чистого растворителя. Это
явление имеет важное значение в природе
и технике. Из приведенного выше выражения
(закона Рауля), с учетом уравнения
Клапейрона — Клаузиуса можно показать[1],
что изменение температуры замерзания
ΔTcr для разбавленных растворов может
быть рассчитано по формуле:
![]()
где ΔHcr — энтальпия замерзания (кристаллизации);
M1 — молярная масса растворителя;
n2
— моляльная концентрация растворенного
вещества. Здесь выражение в квадратных
скобках зависит только от природы
растворителя — это так называемая
криоскопическая постоянная растворителя
k:
![]()
Для воды k = 1,84 K, для железа 110 K[1].Измеряя ΔTcr, можно определить молярную массу растворенного вещества, в соответствии с выражением:
![]()
где a — число граммов растворенного вещества, приходящееся на 1000 граммов растворителя.
Криоскопия
может быть использована для определения
активности растворителя, в соответствии
с соотношением[2]:
![]()
Кроме того, с помощью криоскопии можно определять степень диссоциации слабых электролитов, чистоту вещества, изучать комплексообразование в растворах и пр.
12-билет
1) Константа диссоциации. Закон разведения Оствальда. Теория растворов сильных электролитов
Количественно электролитическую диссоциацию как равновесный обратимый процесс можно охарактери–зовать константой диссоциации (ионизации), опреде–ляемой законом действующих масс.
Закон действующих масс, строго говоря, применим к обратимым реакциям, т. е. к растворам слабых элект–ролитов. Так, например, диссоциацию электролита KtnAnm можно представить в виде равновесного про–цесса:
Ktn Anm × nKtm+ + mAn- .
Согласно закону действующих масс константу рав–новесия записывают следующим образом:
КД = (Ktm+)n+(Ann-)m + (KtnAnm)
где (Ktm+) и (Ann- ) – молярные равновесные концент–рации ионов электролита;
(KtnAnm) – молярная равновесная концентрация недиссоциированных молекул электролита;
КД – константа равновесия, называемая константой диссоциации.
Данное уравнение справедливо лишь для разбавлен–ных растворов слабых электролитов. При применении его к концентрированным растворам и к растворам силь–ных электролитов уравнение нужно видоизменить.
Чем
больше константа диссоциации КД , тем
сильнее диссоциирует электролит. В
отличие от степени диссо–циации КД
зависит только от природы растворителя,
электролита и температуры, но не зависит
от концент–рации раствора. Таким
образом, и константа, и степень
электролитической диссоциации –
количественные ха–рактеристики
диссоциации. Естественно, что между
ними существует связь. Многоосновные
кислоты и многокислотные основа–ния
диссоциируют ступенчато. Например,
диссоциация фосфорной кислоты происходит
в три ступени: ![]()
Аналогично для многокислотных оснований (напри–мер, Са(ОН)2) – диссоциация проходит в две ступени.
Ступенчатая диссоциация характеризуется тем, что распад электролита на каждой последующей ступени происходит в меньшей степени, чем на предыдущей. Такой характер изменения констант диссоциации мож–но объяснить электростатическим притяжением на ос–нове закона Кулона. Энергия ионизации минимальна, когда ион отрывается от нейтральной молекулы элек–тролита. Отрыв иона на каждой следующей ступени диссоциации требует возрастающей энергии, так как удаление иона происходит от частицы, заряд которой на последующих ступенях становится больше. Практически полная диссоциация сильных электроли–тов на ионы вне зависимости от концентрации их раство–ров подтверждается физическими и физико-химиче–скими методами исследования. Так, значения теплоты нейтрализации всех сильных кислот сильными основа–ниями в разбавленных растворах практически одинако–вы. Независимо от природы кислоты и основания по–лучают одинаковое значение АН = –56,5 кДж/моль. Этот факт – наглядное доказательство полной диссо–циации разбавленных растворов кислот и оснований. Во всех случаях общим, протекающим при нейтрали–зации процессом является соединение ионов в м Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая
теория электролитической диссоциации
основана на предположении о неполной
диссоциации растворённого вещества,
характеризуемой степенью диссоциации
α, т. е. долей распавшихся молекул
электролита. Динамическое равновесие
между недиссоциированными молекулами
и ионами описывается законом действующих
масс . Например, электролитическая
диссоциация бинарного электролита KA
выражается уравнением типа:
![]()
13-билет
1). Классическая теория электролитической диссоциации применима лишь к разбавленным растворам слабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. Согласно представлениям, выдвинутым в 20—30-х гг. 20 в. В. К. Семенченко (СССР), Н. Бьеррумом (Дания), Р. М. Фуоссом (США) и др., в растворах сильных электролитов при средних и высоких концентрациях образуются ионные пары и более сложные агрегаты. Современные спектроскопические данные показывают, что ионная пара состоит из двух ионов противоположного знака, находящихся в контакте («контактная ионная пара») или разделённых одной или несколькими молекулами растворителя («разделённая ионная пара»). Ионные пары электрически нейтральны и не принимают участия в переносе электричества. В сравнительно разбавленных растворах сильных электролитов равновесие между отдельными сольватированными ионами и ионными парами может быть приближённо охарактеризовано, аналогично классической теории электролитической диссоциации, константой диссоциации (или обратной величиной — константой ассоциации). Это позволяет использовать вышеприведённое уравнение для расчёта соответствующей степени диссоциации, исходя из экспериментальных данных.
В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.
Протолитическая (протонная) теория кислот и оснований была предложена в 1923 году независимо друг от друга датским учёным Й. Брёнстедом и английским учёным Т. Лоури. В ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии: А В + Н+ (А - кислота, В - основание). Согласно этой теории кислотами являются молекулы или ионы, способные быть в данной реакции донорами протонов, а основаниями являются молекулы или ионы, присоединяющие протоны (акцепторы). Кислоты и основания получили общее название протолитов.
Сущностью кислотно-основного взаимодействия является передача протона от кислоты к основанию. При этом кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание, образуя протонированную частицу, становится кислотой. Таким образом, в любом кислотно-основном взаимодействии участвуют две пары кислот и оснований, названные Бренстедом сопряженными: А1 + В2 А2 + В1.Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность). Например, вода при взаимодействии с сильными кислотами является основанием: H2O + H+ H3О+, а реагируя с аммиаком, становится кислотой: NH3 + H2O NH4+ + OH−.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения электронов. К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. Первые в виде ионов существуют еще до перевода их в растворенное или расплавленное состояние. К электролитам относятся соли, основания и кислоты. Электролиты являются проводниками второго рода. Передача электричества в них осуществляется движением положительных и отрицательных ионов, а в проводниках первого рода (металлах) – движением электронного газа. Сила электролита в значительной степени зависит от природы растворителя. Мерой воздействия растворителя является диэлектрическая проницаемость, значение которой для воды весьма высока и при 20 град. Равно 81. Именно для воды свойство ослаблять химические связи между ионами особенно сильно. Различают сильные и слабые электролиты. Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся: почти все растворимые соли; многие неорганические кислоты, гидроксиды щелочных и щелочноземельных металлов. Слабые электролиты при растворении в воде незначительно диссоциируют на ионы. К ним относятся: почти все органические кислоты; некоторые неорганические кислоты (угольная и сернистая), многие гидроксиды, аммиак. Вода также является слабым электролитом. Деление электролитов на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих электролитов, а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др. По количеству ионов, на которые диссоциирует в растворе одна молекула, различают: бинарные, или одно-одновалентные электролиты (КС1), одно-двухвалентные электролиты (CaCl2) и т. д. Свойства разбавленных растворов слабых электролитов удовлетворительно описываются классической теорией электролитической диссоциации – процесса распада электролита на ионы при растворении его в воде. При растворении в воде веществ с ионной связью полярные молекулы воды притягиваются полюсами к положительно заряженным ионам вещества. В результате электростатическое притяжение между ионами в решетке понижается и ионы переходят в раствор. Живой организм представляет собой огромную химическую фабрику, где ни на секунду не останавливается производство. Постоянно происходит синтез, распад, окисление, выделение тех или иных химических веществ, благодаря которому организм живет, так как одним из признаков живого является постоянный обмен веществ и энергии с окружающей средой. Одним из основных (по значению и по количеству) веществ, содержащих в организме является вода, в которой растворены другие химические соединения. Большое значение среди них имеют электролиты.
Кисло́тно-осно́вное равнове́сие — относительное постоянство соотношения кислота-основание внутренней среды живого организма. Также называют кисло́тно-щелочно́е равнове́сие, кислотно-щелочной баланс, равновесие кислот и оснований. Является составной частью гомеостаза. Количественно характеризуется либо концентрацией водородных ионов (протонов) в молях на 1 л, либо водородным показателем pH. Ткани живого организма весьма чувствительны к колебаниям показателя pH — за пределами допустимого диапазона (7,37—7,44), происходит денатурация белков: разрушаются клетки, ферменты теряют способность выполнять свои функции, возможна гибель организма. Поэтому кисло́тно-щелочно́й баланс в организме жёстко регулируется. Существует несколько буферных систем, которые обратимо связывают ионы водорода и препятствуют каким-либо изменениям показателя рН. Бикарбонатная буферная система (мощная и наиболее управляемая среди буферных систем) имеет особо важное значение: избыток протонов (H+, ионов водорода) взаимодействует с ионами бикарбоната (HCO3−) с образованием угольной кислоты (H2CO3). В дальнейшем уменьшение количества угольной кислоты происходит в результате ускоренного выделения углекислого газа (CO2) в результате гипервентиляции лёгких (концентрация определяется давлением в альвеолярной газовой смеси)
14-билет
1). Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Равновесие
этой реакции сильно смещено влево.
Константу диссоциации воды можно
вычислить по формуле:
![]() где:
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8×10−16моль/л.
Обозначим произведение K·[H2O] = Kв = 1,8×10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH).
Так
как Kв — константа, при добавлении к
раствору кислоты (ионов H+), концентрация
гидроксид-ионов OH− будет падать и
наоборот. В нейтральной среде [H+] = [OH−]
=
![]() моль/л.
При концентрации [H+] > 10−7 моль/л
(соответственно, концентрации [OH−] <
10−7 моль/л) среда будет кислой; При
концентрации [OH−] > 10−7 моль/л
(соответственно, концентрации [H+] <
10−7 моль/л) — щелочной.
моль/л.
При концентрации [H+] > 10−7 моль/л
(соответственно, концентрации [OH−] <
10−7 моль/л) среда будет кислой; При
концентрации [OH−] > 10−7 моль/л
(соответственно, концентрации [H+] <
10−7 моль/л) — щелочной.
Водородный
показатель, pH — мера активности ионов
водорода в растворе, и количественно
выражающая его кислотность, вычисляется
как отрицательный десятичный логарифм
активности водородных ионов, выраженной
в молях на литр:
![]()
В чистой воде при 22 °C концентрации ионов водорода и гидроксид-ионов одинаковы и составляют 10 моль/л, это напрямую следует из определения ионного произведения воды, которое равно · и составляет 10 моль²/л².
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда > говорят, что раствор является кислым, а при > — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно, чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
Влияние температуры на значения pH
0.001 моль/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3
0.001 моль/Л NaOH при 20 °C имеет pH=11.73, при 30 °C pH=10.83
Влияние температуры на значения pH объяснятеся различной диссоциацией ионов водорода и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
15-билет
