
- •Будова алкенів, стан гібридизації атому Карбону
- •Гомологічний ряд алкенів – СnH2n
- •Етеніл (вініл) Ізомерія алкенів
- •Старшинство замісників біля хірального центра
- •Фізичні властивості
- •Хімічні властивості
- •1) Гідрування, гідрогенізація (приєднання водню)
- •2) Галогенування (приєднання галогенів) – ае-приєднання.
- •3) Гідрогалогенування (приєднання гідрогалогенводнів)
- •Іі. Реакції окиснення
- •Ііі. Реакції полімеризації
- •Будова алкадієнів
- •У спряжених дієнів відбувається додаткове перекривання р-електронних хмар сусідніх -звязків (,-спряження) та утворюється єдина -електронна система. Наприклад, у бутадієну-1,3:
- •І.Реакції приєднання
- •Іі. Реакція полімеризації
- •Iіі. Реакції заміщення
- •V. Полімеризація алкінів.
- •2. Поліетилен високої щільності (hdpe)
- •3. Полівінілхлорид (pvc / V)
- •4. Поліетилен низької щільності (ldpe)
- •5. Поліпропілен (pp)
- •6. Полістирол (ps)
- •7. Інші види пластмас
У спряжених дієнів відбувається додаткове перекривання р-електронних хмар сусідніх -звязків (,-спряження) та утворюється єдина -електронна система. Наприклад, у бутадієну-1,3:
В результаті ,-спряження -звязок стає коротшим:

Так, в молекулі бутадієну-1,3 довжина звязку С2-С3 складає 0,148нм (в етані С-С – 0,154нм).
Дієниз ізольованими подвійними звязками побудовані аналогічно алкенам.
Спряжені дієни.
Спряжені дієни проявляють ненасичений характер. Навність спряженої системи в їх молекулі призводить до того, що вони приєднують різні речовини не тільки по місцю одного подвійного звязку (1,2-приєднання), але й до кінцевих атомів спряженої системи з переміщенням подвійного звязку (1,4-приєднання). Співвідношення цих продуктів залежить від умов реакції і природи електрофільного реагента.
І.Реакції приєднання
Гідрування (приєднання водню) – АЕ, АN, АR
Н 2С
= С = СН2
+ Н2
Н3С
– СН = СН2
2С
= С = СН2
+ Н2
Н3С
– СН = СН2
kt


 1,4 Н3С
– СН = СН – СН3
1,4 Н3С
– СН = СН – СН3
Н2С = СН – СН = СН2 + Н2 + Н2, kt
kt Н3С – СН2 – СН = СН2
1,2
![]()
2) Галогенування (приєднання галогенів) - АЕ – утворюється суміш продуктів 1,2- і 1,4-приєднання - залежить від Т, каталізатора, природи галогена.

 50% Н2С
– СН – СН = СН2
50% Н2С
– СН – СН = СН2
 1,2
│ │
1,2
│ │
 кімн.Т
Cl
Cl
+ Cl2
кімн.Т
Cl
Cl
+ Cl2
Н2С = СН – СН = СН2 + Cl2
50% Н2С – СН = СН – СН2
1,4 │ │
Cl Cl
Н2С – СН – СН – СН2
│ │ │ │
Cl Cl Cl Cl
-80°C 80% 1,2 - Н2С – СН – СН = СН2 і 20% 1,4
│ │
Br Br
Н2С = СН – СН = СН2 + Br2
+40°С 80% 1,4 Н2С – СН = СН – СН2 і 20% 1,2
│ │
Br Br
Зв’язок С—Br слабший від С—Cl
Приєднання галогенів до спряжених дієнів відбувається за електрофільним механізмом. Особливістю останнього є те, що електрофільна частинка атакує кінцевий атом Карбону спряженої системи, оскільки при цьому утворюється мезамерно стабілізований карбкатіон, будову якого можна представити структурами І і ІІ:

Послідуюча атака карбкатіону бромід-іоном призводить до утворення продуктів 1,2-(ІІІ) і 1,4-приєднання (IV)
2) Гідрогалогенування (приєднання галогенводнів) - АЕ
Н3С – СН – СН = СН2
1,2 │
Cl
Н2С = СН – СН = СН2 + HCl
Н3С – СН = СН – СН2
1,4 │
Cl
Іі. Реакція полімеризації
Розрізняють синтетичні і натуральні каучуки.
Продукти полімеризації спряжених 1,3-дієнів називають синтетичний каучук (СК). Це каучуки загального призначення.
СКБ – синтетичний каучук бутадієновий
С Н2 = СН – СН = СН2 1,4 (-СН2 – СН = СН – СН2 -)n


С Н2 = СН – СН = СН2 1,2 -СН2 – СН –
│
CH
║ n
CH2
СКІ – синтетичний каучук ізопреновий
В
 икористовують
для заміни натурального каучука у
виробництві шин ті інших гумово-технічних
засобів.
икористовують
для заміни натурального каучука у
виробництві шин ті інших гумово-технічних
засобів.
-H2C CH2 -
n
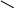 СН2
= С
– СН = СН2
C
= C
СН2
= С
– СН = СН2
C
= C
│ H3C H n
CH3
3) СКХ – синтетичний каучук хлоропреновий (совпрен, неопрен, дюпрен). Має високу світлостійкість, маслостійкість, інертний до дії багатьох органічних розчинників і використовується як ізоляційний матеріал.
n

 СН2
= С
– СН = СН2
-
CH2
– C
= CH
– CH2
-
СН2
= С
– СН = СН2
-
CH2
– C
= CH
– CH2
-
│ │
Cl Cl n
4) БСК – бутадієнстирольний каучук = 3 частини дивінілу + 1 частина стиролу. Використовується для виготовлення автошин, підошв для взуття.
3 n
СН2
= СН – СН = СН2
+ n
СН2
= СН
n
СН2
= СН – СН = СН2
+ n
СН2
= СН
│
 С6Н5
С6Н5
 (-СН2
– СН = СН – СН2)3
– СН2
– СН –
(-СН2
– СН = СН – СН2)3
– СН2
– СН –
│
С6Н5 n
5) БНК – бутадієннітрильний каучук (СКН – синтетичний каучук нітрильний) = дивініл + акрилонітрил. Мають високу масло- і бензостійкість, стійкі до Т˚. використовуються для виготовлення шлангів, м’яких гум. У вигляді латексу СКН використовують при виробництві паперу і нетканних текстильних виробів.
n СН2 = СН – СН = СН2 + n СН2 = СН (-СН2 – СН = СН – СН2 – СН2 – СН – ) n
│ │
СN СN
Натуральний каучук добувають з соку тропічного дерева – гевея.
Одне дерево протягом року дає від 500 до 2000кг у вигляді молочного соку, який називається латексом і складається на 35-40% з каучуку, а на 55-60% - з води. З латексу каучук виділяють шляхом коагуляції. Для цього сирий латекс спочатку очищають, а потім коагулюють дією оцтової к-ти або нагріванням. Каучук, який при цьому виділяється у вигляді пружної аморфної маси, промивають, механічно обробляють, вносять наповнювачі, вулканізують добавлянням сірки і перетворюють таким чином на гуму.
За хімічним складом натуральний каучук являє собою лінійний стереорегулярний полімер ізопрену (поліізопрен), що має цис-конфігурацію ізопренових ланок (М.м. 100 000 – 150 000):

Високомолекулярні сполуки (полімери)
Загальна характеристика
Полімером даної речовини називають речовину, що складається з великої кількості її основних структурних фрагментів
Мономер - речовина, що здатна утворювати полімери
Як приклад, можна розглянути реакції утворення поліетилену і гліцилгліцину:
Основним структурним фрагментом (структурною ланкою) полімеру слід вважати такий, що відтворює основні структурні особливості мономерів. До неосновних структурних фрагментів відносять кінцеві групи.
Поширення у природі
Природні полімери (так звані біополімери) складають основу життєдіяльності будь-якого живого організму. Ключову роль у життєдіяльності відіграють нуклеїнові кислоти* і білки; важлива роль належить також полімерним вуглеводам (полісахаридам) - крохмалю, целюлозі і глікогену.
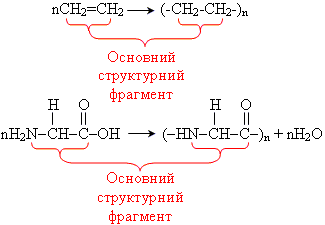
Класифікація
• класифікація за
геометричною формою макромолекул
класифікація за
геометричною формою макромолекул
- лінійна форма, наприклад: поліетилен, природний поліізопрен, що входить до складу природного каучуку
- розгалужена форма, наприклад: крохмаль, глікоген
- просторова форма, наприклад: вулканізований каучук
Структури ВМС:
а) лінійна; б) розгалужена; в) просторова
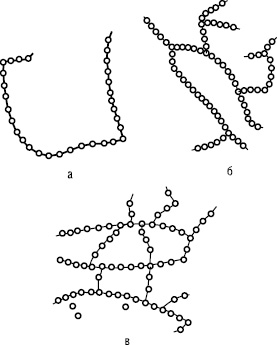
Способи утворення полімерів
• полімеризація - процес послідовного з'єднання молекул мономеру за реакцією приєднання.
Наприклад, реакція утворення поліхлорвінілу:
![]()
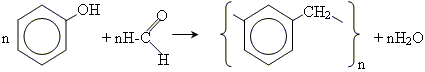
• поліконденсація - процес послідовного з'єднання молекул мономеру за реакцією заміщення, що супроводжується виділенням низькомолекулярних речовин.
Наприклад, реакція утворення фенолформальдегідних смол (новолак, резол):
Використання:
• Виготовлення конструкційних, електроізоляційних, клейових матеріалів
• Харчова промисловість
• Виготовлення лікарських препаратів
• Виготовлення побутових виробів
ВМС відіграють велику роль у процесах життєдіяльності, а також у різних галузях науки і техніки. Біополімери є основою всіх живих організмів і беруть участь у всіх процесах життєдіяльності. ВМС — основа пластичних мас, хімічних волокон, лаків, фарб, клеїв, герметиків, іонообмінних смол. У медицині полімери застосовують для виготовлення виробів медичної техніки (інструменти, предмети догляду за хворими, матеріали і вироби для пакування ліків), у відновній хірургії для заміни втрачених органів (протези, корпуси і деталі штучних шлуночків та стимуляторів серця, протези кровоносних судин, деталі апаратів «штучна нирка», «серце–легені», замінники кісткових тканин). ВМС використовують як напівпроникні мембрани в апаратах штучного кровообігу, перитоніального діалізу. У фармації полімери використовують як речовини спрямованої біологічної дії (ліки або компоненти лікарських форм). У цьому плані слід відзначити полімери, які мають властивості подовжувати дію лікарських речовин в організмі (пролонгування), а також розчини полімерів, які застосовуються як крово- і плазмозамінники (полівінілпіролідон, полівініловий спирт, декстран, желатин тощо). Велике значення мають полімери як допоміжні речовини (див. Допоміжні речовини) для створення різних лікарських форм. Поліетиленгліколі використовують як замінники жирових основ і вазеліну, розчинники та як АФІ; полівініловий спирт — як основа водорозчинних мазей, а також як стабілізатор розчинів, суспензій, емульсій (напр. суспензії інсуліну), речовин з кровоспинними властивостями (порошки полівінілового спирту з хлоридом заліза (ІІІ)). Полівінілпіролідон використовують як основу мазей, кремів і ліків для шкіри. Полімери застосовують для виготовлення оболонок капсул, а також як покриття і складові таблеток. Модифіковану целюлозу використовують для виготовлення бинтів та вати зі кровоспинними властивостями. Антимікробні волокна на основі природних полімерів — целюлози і альгінатів або синтетичних ВМС (полівініловий спирт та ін.) — здатні затримувати ріст різних мікроорганізмів. Їх одержують внаслідок хімічної взаємодії бактерицидного чи фунгіцидного препарату з макромолекулами волокноутворювального полімеру або просочуванням розчином, емульсією чи суспензією готових полімерних волокон. Такі волокна застосовують для виготовлення перев’язувальних матеріалів, спеціальних масок, предметів особистої гігієни тощо.
Поліетилен [–CH2–CH2–]n існує в двох модифікаціях, що відрізняються за структурою, а виходить, і по властивостях. Обидві модифікації виходять з етилену CH2=CH2. В одній з форм мономери зв'язані в лінійні ланцюги (див. мал. 1); в іншій – розгалуження з 4–6 вуглецевих атомів приєднані до основного ланцюга випадковим способом.
Лінійні поліетилени виробляються з використанням особливих каталізаторів, полімеризація протікає при помірних температурах (до 150° С) і тисках (до 20 атм).
Лінійні поліетилени утворюють область кристалічності, що сильно впливають на фізичні властивості зразків. Цей тип поліетилену (див. таблицю) звичайно називають поліетиленом високої щільності; він являє собою дуже твердий, міцний і твердий термопласт, широко застосовуваний для литьєвого і видувного формування (див. нижче) ємкостей, використовуваних у домашнім господарстві і промисловості. Поліетилен високої щільності міцніший поліетилену з низькою щільністю.
ВЛАСТИВОСТІ ПОЛІЕТИЛЕНА ВИСОКОЇ ЩІЛЬНОСТІ |
|
СП |
від 1000 до 50 000 |
Тпл |
129–135° С |
Тст |
ок. –60° С |
Щільність |
0,95–0,96 г/см3 |
Кристалічність |
висока |
Розчинність |
розчинний в ароматичних вуглеводнях тільки при температурах вище 120° С |
Розгалужені поліетилени спочатку одержували нагріванням етилена (зі слідами кисню як ініціатора) до температур порядку 200° С при дуже високих тисках (понад 1500 атм). Розгалуження зменшують здатність поліетилена до кристалізації, у результаті цей різновид поліетилена має наступні властивості:
ВЛАСТИВОСТІ ПОЛІЕТИЛЕНА НИЗКОЮ ЩІЛЬНОСТІ |
|
СП |
від 800 до 80 000 |
Тпл |
108–115° С |
Тст |
нижче –60° С |
Щільність |
0,92–0,94 г/см3 |
Кристалічність |
низька |
Розчинність |
розчинний в ароматичних вуглеводнях тільки при температурах вище 80° С |
Цей поліетилен звичайно називають поліетиленом низкою щільності. Розроблено методи одержання поліетилена низкою щільності при низькому тиску і помірних температурах сополімеризацією етилена з іншим олефином, наприклад бутиленом CH2=CH–CH2–CH3. Там, де в ланцюг убудовується бутиленова одиниця, утвориться короткий бічний ланцюг:
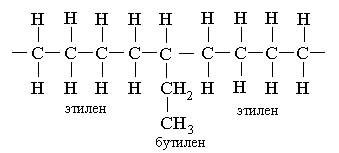
У цьому випадку упакування ланцюгів не може бути настільки ж щільної, як для «чистого» поліетилена. Поліетилен низкою щільності являє собою міцний, дуже гнучкий і злегка пружний термопласт, трохи більш м'який, легше формується і що видавлюється, чим поліетилен високої щільності; поліетилен низкою щільності знаходить широке застосування у виробництві покрить, пакувальних матеріалів і виробів, виготовлених методом литьєвого формування.
Поліетилен - один з найбільш корисних і важливих пластичних матеріалів. Деталі електронних пристроїв, покриття картонних молочних пакетів, пакувальні плівки й іграшки - от далеко не повний перелік того, що роблять з поліетилену.
По походженню полімери поділяються на природні (біополімери), наприклад білки, нуклеїнові кислоти, смоли природні, і синтетичні, наприклад поліетилен, поліпропілен, феноло-формальдеговані смоли.
Полімери, молекули яких складаються з однакових мономерних ланок, називаються гомополімерами (наприклад полівінілхлорид, полікапроамід, целюлоза).
У залежності від складу основної (головної) ланцюга полімери, поділяють на: гетероцепні, в основному ланцюзі яких містяться атоми різних елементів, найчастіше вуглецю, азоту, кремнію, фосфору, і гомоцепні, основні ланцюги яких побудовані з однакових атомів. З гомоцепні полімерів найбільш поширені карбоцепні полімери, головні ланцюги яких складаються тільки з атомів вуглецю, наприклад поліетилен, поліметилметакрилат, политетрафторзтілен. Приклади гетероцепних полімерів - поліефіри (полиетилентерефталат, полікарбонати), поліаміди, мочевино-формальдегідні смоли, білки, деякі кремнійорганічні полімери. Полімери, макромолекули яких поряд з вуглеводні групами містять атоми неорганогенних елементів, називаються елементоорганічні. Окрему групу полімерів утворять неорганічні полімери, наприклад пластична сірка, поліфосфонітрилхлорид.
Сьогодні можна говоритити щонайменше про чотири основні напрямки використання полімерних матеріалів у сільському господарстві. І у вітчизняній і у світовій практиці перше місце належить плівкам. Завдяки застосуванню мульчируючої перфорованої плівки на полях врожайність деяких культур підвищується до 30%, а терміни дозрівання прискорюються на 10-14 днів.
Використання поліетиленової плівки для гідроізоляції створюваних водоймищ забезпечує істотне зниження утрат вологи, що запасається. Укриття плівкою сінажу, силосу, грубих кормів забезпечує їхню кращу схоронність навіть у несприятливих погодних умовах. Але головна область використання плівкових полімерних матеріалів у сільському господарстві - будівництво й експлуатація плівкових теплиць. В даний час стало технічно можливим випускати полотнища плівки шириною до 16 м, а це дозволяє будувати плівкові теплиці шириною в підставі до 7,5 і довжиною до 200 м. У таких теплицях можна всі сільськогосподарські роботи проводити механізовано; більш того, ці теплиці дозволяють вирощувати продукцію круглорічно. У холодний час теплиці обігріваються знов-таки за допомогою полімерних труб, закладених у ґрунт на глибину 60-70 див.
З погляду хімічної структури полімерів, використовуваних у тепличних господарствах такого роду, можна відзначити переважне використання поліетилену, непластифікованого полівінілхлориду й у меншій мері поліамідів.
Поліетиленові плівки відрізняються кращою світлопроникністю, кращими властивостями міцності, але гіршої погодостійкості і порівняно високими тепловтратами. Вони можуть справно служити лише 1-2 сезону. Поліамідні й інші плівки поки застосовуються порівняно рідко.
Інша область широкого застосування полімерних матеріалів у сільському господарстві - меліорація. Отут і різноманітні форми труб і шлангів для поливу, особливо для самого прогресивних у даний час краплинного зрошення; отут і перфоровані пластмасові труби для дренажу. Цікаво відзначити, що термін служби пластмасових труб у системах дренажу, напри мір, у республіках Прибалтики в 3-4 рази довше, ніж відповідних керамічних труб. На кінець використання пластмасових труб, особливо з гофрованого полівінілхлориду, дозволяє майже цілком виключити ручна праця при прокладці дренажних систем.
Два інших головних напрямки використання полімерних матеріалів у сільському господарстві - будівництво, особливо тваринницьких приміщень, і машинобудування.
Як на практиці можна і, власне, вже використовують поліетилен?
Вівця, як відомо, тваринне нерозумне. Особливо - меринос. Знає адже, що вовна потрібна хазяїну чистої а все-таки те в пилу виваляється, те, продираючи по шмат там, колючок на себе начіплює. Мити і чистити овечу вовну після стрижки - процес складний і трудомісткий. Щоб спростити його, щоб захистити вовна від забруднень, австралійські вівчарі винайшли попону з поліетиленової тканини. Надягають її на вівцю відразу після стрижки, затягують гумовими застібками. Вівця росте, і вовна на ній росте, розпирає попону, а гумки слабшають, попона увесь час як по мірці зшита. Але от лихо: під австралійським сонцем сам поліетилен стає м’яким. І з цим справилися за допомогою амінних стабілізаторів. Залишилося ще привчити вівцю не рвати поліетиленову тканину об колючки і паркани.
Алкіни – це ненасичені вуглеводні, які містять один потрійниЙ зв’язок —С≡С—. Загальна формула СnH2n-2.
Гомологічний ряд. Номенклатура.
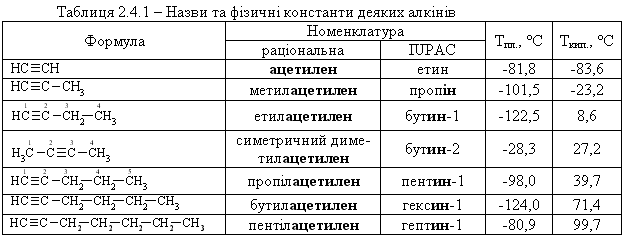
Назви залишків алкінів утворюють шляхом додавання закінчення –іл до назви вуглеводню:
НС≡С— етиніл (ацетиленіл)
СН3—С≡С— пропініл-1
НС≡С—СН2— пропініл-2 (пропаргіл)
СН3—С≡С—СН2— бутиніл-2
Нумерацію карбонового ланцюга починають з того боку, до якого ближче розташований потрійний звязок:

Будова потрійного зв’язку.
Потрійний зв’язок складається з одного σ- і двох π-зв’язків. Найпростішим представником сполук з таким зв’язком є ацетилен НС≡СН
Атом Карбону знаходиться в стані sp-гібридизації (третій валентний стан).
1s + 1p = 2sp



+ =

Г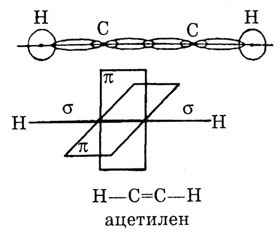 ібридні
орбіталі обох атомів Карбону розташовані
одна до однох під кутом 180˚ (лінійна
гібридизація).
ібридні
орбіталі обох атомів Карбону розташовані
одна до однох під кутом 180˚ (лінійна
гібридизація).
Дві негібридні р-орбіталі, які утворюють π-зв’язки, орієнтовані в просторі у взаємно перпендикулярних площинах.
Довжина звязку С≡С 0,120нм.
Ізомерія алкінів
Структурна
- Ізомерія карбонового ланцюга
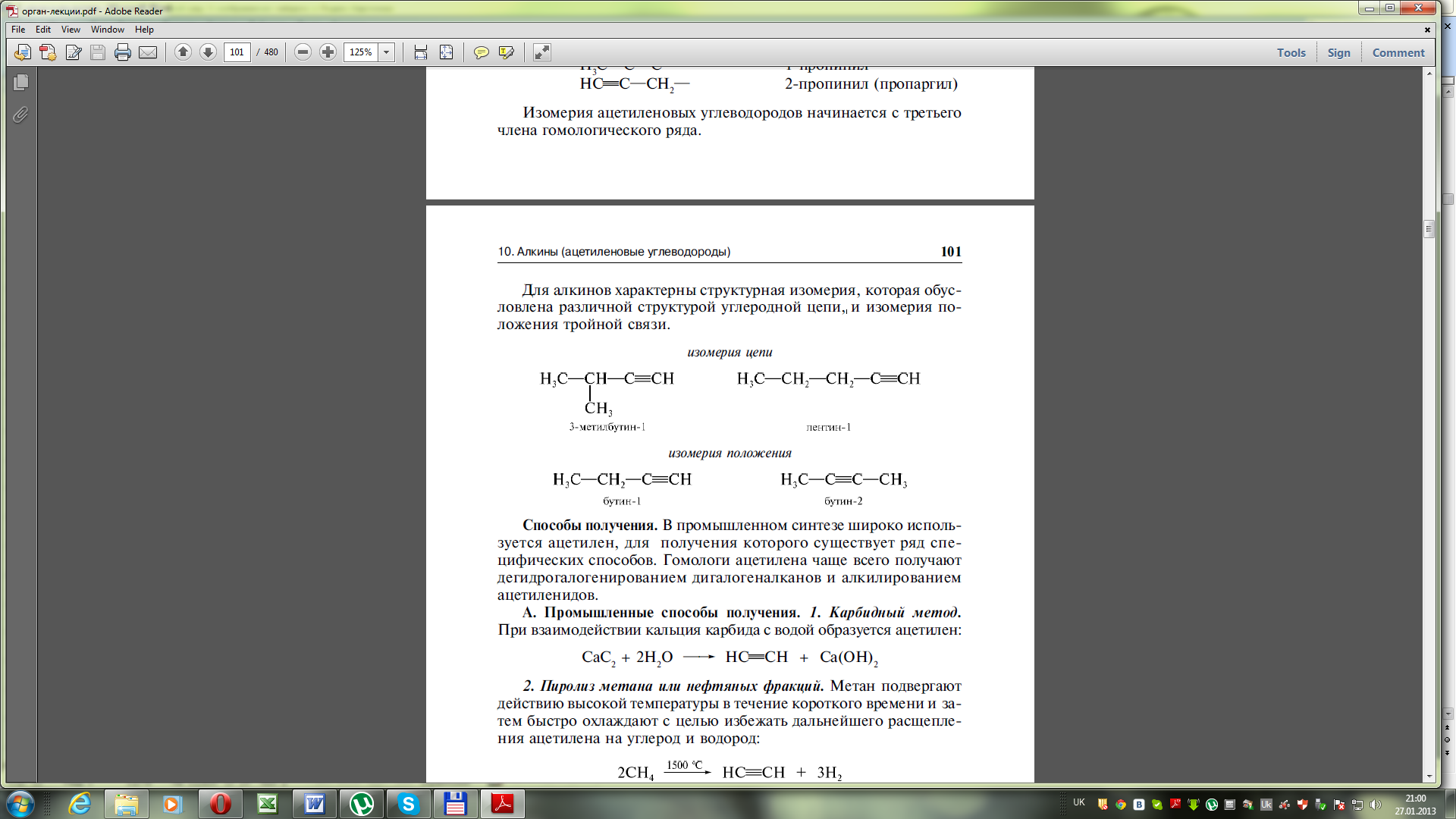
- Положення потрійного зв’язку
Міжкласова (алкіни ізомерні алкадієнам)
і СН2=СН-СН=СН2 – бутадієн-1,3
Добування алкінів
Карбідний метод
С аСО3 СаО + СО2

Фізичні властивості
С2—С4 – гази, С5—С15 – рідини, а від С16 – тверді речовини. Температури кипіння і плавлення, густина зростають із збільшення молекулярної маси алкінів.
Хімічні властивості
Ацетилен характеризується лінійною будовою, довжина потрійного зв’язку значно коротша за довжину одинарного і подвійного зв’язків. π-електронна густина потрійного зв’язку ацетилену поляризується важче порівняно з подвійним зв’язком. Електронегативність атому Карбону в sp-гібридизованому стані вища, ніж у sp2-гібридизованому стані. Внаслідок цього π-електрони потрійного зв’язку ацетилену більш стягнуті до середини молекули і менш рухливі, сильніше утримуються атомами Карбону, ніж біля подвійного зв’язку. Отже, зовнішні електрони в ацетилені міцніше зв’язані з атомами Карбону, ніж в етилені. Тому алкіни проявляють меншу реакційну здатність до реакцій електрофільного приєднання АЕ порівняно з алкенами.
Алкіни вступають в реакції приєднання (за радикальним, електрофільним та нуклеофільним механізмами) та реакції заміщення атомів Гідрогену, розміщених біля атому Карбону з потрійним зв’язком.
І. Гідрування (приєднання водню)
Залежно від природи каталізатора утворюються транс- або цис-продукти. Лужні метали у рідкому аміаку сприяють утворенню транс-продуктів, а паладій, залізо сприяють отриманню цис-продуктів:
Відбувається в основному в дві стадії.

ІІ. Реакції електрофільного приєднання АЕ:
1) Галогенування (приєднання галогенів) – приєднання за місцем потрійного зв’язку брому і хлору відрізняються між собою швидкістю. З метою уникнення вибуху хлорування проводять у рідкій фазі (у розчинниках). Знебарвлення бромної води – якісна реакція на потрійний звязок:

Гідрогалогенування (приєднання галогенводнів) також проходить в дві стадії. Гідрогалогенування несиметричних алкінів здійснюється за правилом Морковнікова і відбувається переважно транс-приєднання.
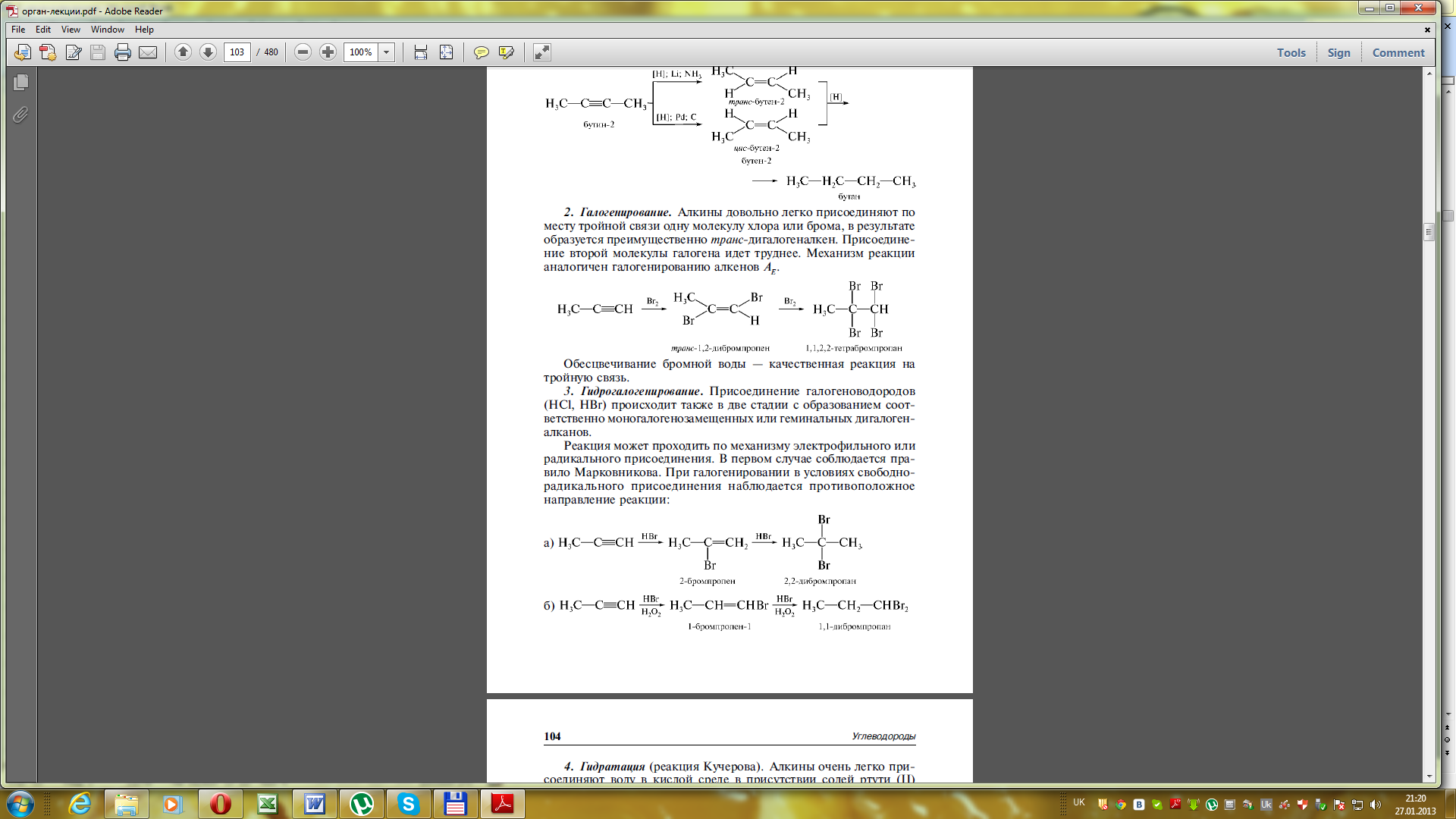
4) Гідратація (приєднання води) – утворюються карбонільні сполуки (альдегіди, кетони).
Гідратація ацетилену (реакція Кучерова) відбувається в присутності 10%-ої сульфатної к-ти і 5% меркурій (ІІ) сульфату, при цьому утворюється оцтовий альдегід.
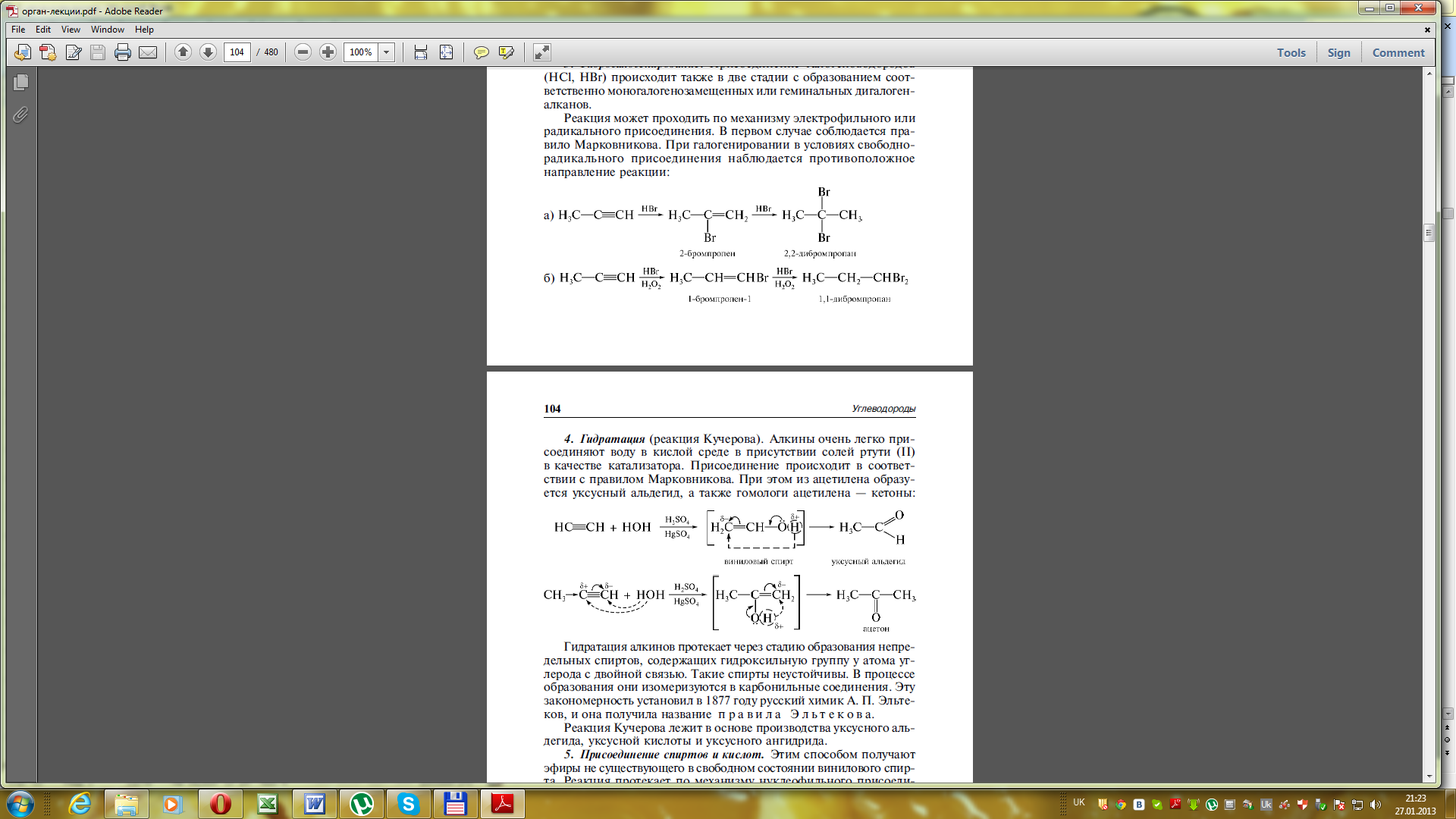
Вініловий спирт оцтовий альдегід
При гідратації утворюються спирти, в яких ОН-група сполучена з атомом Карбону подвійного зв’язку (еноли).
Вчений Ельтеков сформулював правило: ненасичені спирти з ОН-групою біля подвійного зв’язку нестійкі і швидко ізомеризуються в стійкі карбонільні сполуки (альдегіди і кетони).
Решта алкінів при гідратації перетворюються на кетони.
