
- •Будова алкенів, стан гібридизації атому Карбону
- •Гомологічний ряд алкенів – СnH2n
- •Етеніл (вініл) Ізомерія алкенів
- •Старшинство замісників біля хірального центра
- •Фізичні властивості
- •Хімічні властивості
- •1) Гідрування, гідрогенізація (приєднання водню)
- •2) Галогенування (приєднання галогенів) – ае-приєднання.
- •3) Гідрогалогенування (приєднання гідрогалогенводнів)
- •Іі. Реакції окиснення
- •Ііі. Реакції полімеризації
- •Будова алкадієнів
- •У спряжених дієнів відбувається додаткове перекривання р-електронних хмар сусідніх -звязків (,-спряження) та утворюється єдина -електронна система. Наприклад, у бутадієну-1,3:
- •І.Реакції приєднання
- •Іі. Реакція полімеризації
- •Iіі. Реакції заміщення
- •V. Полімеризація алкінів.
- •2. Поліетилен високої щільності (hdpe)
- •3. Полівінілхлорид (pvc / V)
- •4. Поліетилен низької щільності (ldpe)
- •5. Поліпропілен (pp)
- •6. Полістирол (ps)
- •7. Інші види пластмас
Ііі. Реакції полімеризації
Це реакції утворення полімеру (ВМС) за рахунок з’єднання між собою великої кількості молекул ненасичених низькомолекулярних сполук (мономерів) ковалентними зв’язками, які виникають внаслідок розриву π-зв’язків у молекулах мономерів.
Полімеризацію можна розглядати як своєрідне хімічне множення молекул мономерів з утворенням молекул полімерів.

Група - це елементарна ланка полімеру (тобто елементарний склад полімеру не відрізняється від складу мономеру), n – ступінь полімеризації.
Добування алкенів
З природних джерел (нафта, природний газ).
Крекінгі вищих алканів
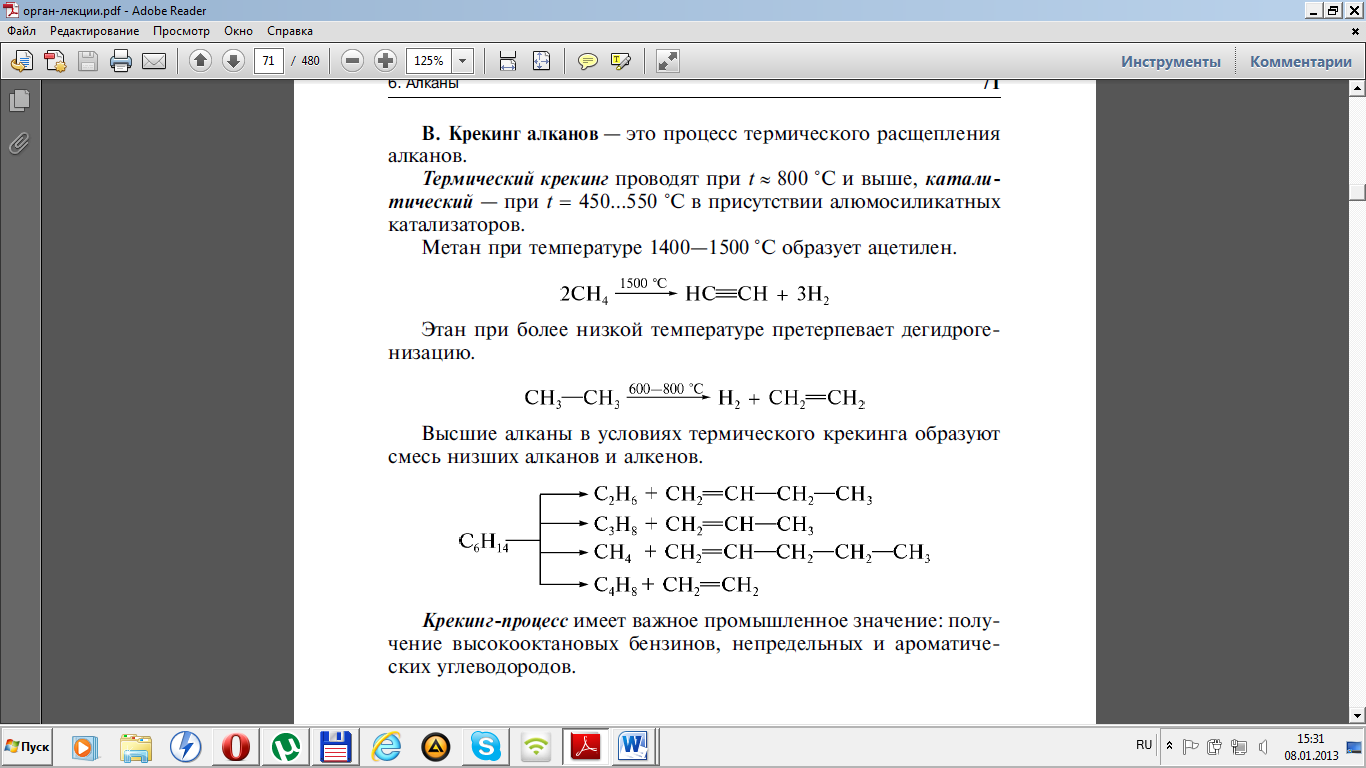
3. Дегідрування алканів – відщеплення водню
CnH2n+2 = CnH2n + H2
С2Н6 = С2Н4 + Н2
Дегідратація насичених одноатомних спиртів (водовіднімаючий реагент – сульфатна або фосфатна кислоти):

Відщеплення води від спиртів з розгалуженою будовою підпорядковується правилу Зайцева: атом Гідрогену відщеплюється від найменш гідрогенізованого сусіднього атому Карбону:
5. Дегідрогалогенування галогеналканів (відщеплення галогенводнів від галогеналканів) при дії спиртового розчину лугу на моногалогеналкани:
6. Неповне гідрування алкінів
CnH2n-2 + H2 = CnH2n
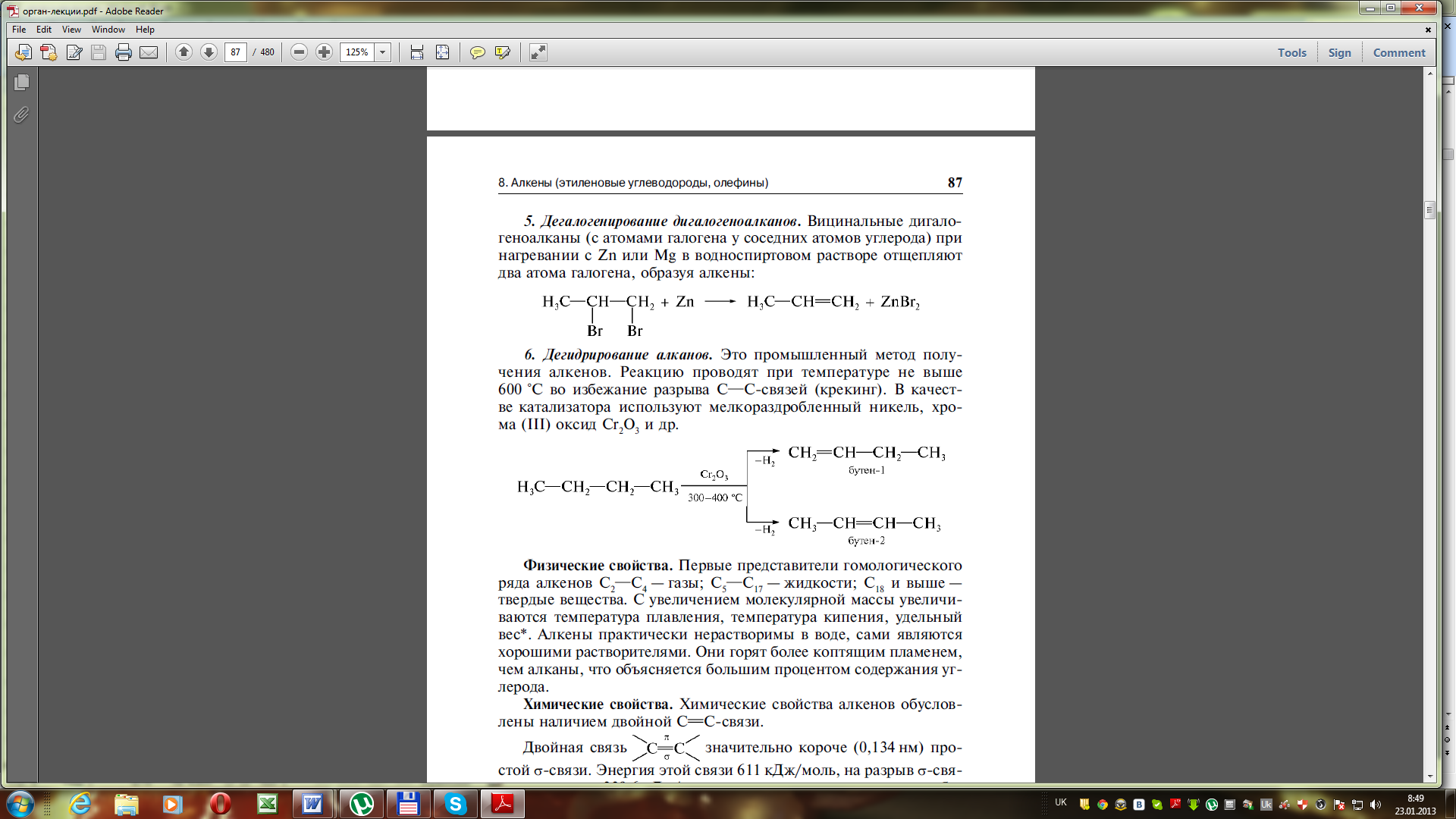
7. Дегалогенування віцинальних дигалогеналканів (при нагріванні з цинком або магнієм):
Ненасичені вуглеводні з двома подвійними зв’язками називають алкадієни (діолефіни) або дієнові вуглеводні. Загальна формула CnH2n-2.
Залежно від взаємного розміщення подвійних зв’язків алкадієни поділяють на три групи:
Кумулени (алени) – в їх молекулах два подвійних зв’язки розміщені біля одного атома Карбону (пропандієн, ален).
Дієни з ізольованими подвійними зв’язками – в молекулах цих дієнів подвійні зв’язки відділені однією або кількома групами -СН2- (гексадієн-1,5).
Спряжені (кон’юговані) – в молекулах цих дієнів подвійні зв’язки чергуються з одинарними (бутадієн-1,3, дивініл)
Навзи алкадієнів за замісниковою номенклатурою ІЮПАК утворюються шляхом додавання до кореня насиченого вуглеводню суфіксу –дієн із вказівкою положення кожного подвійного звязку.
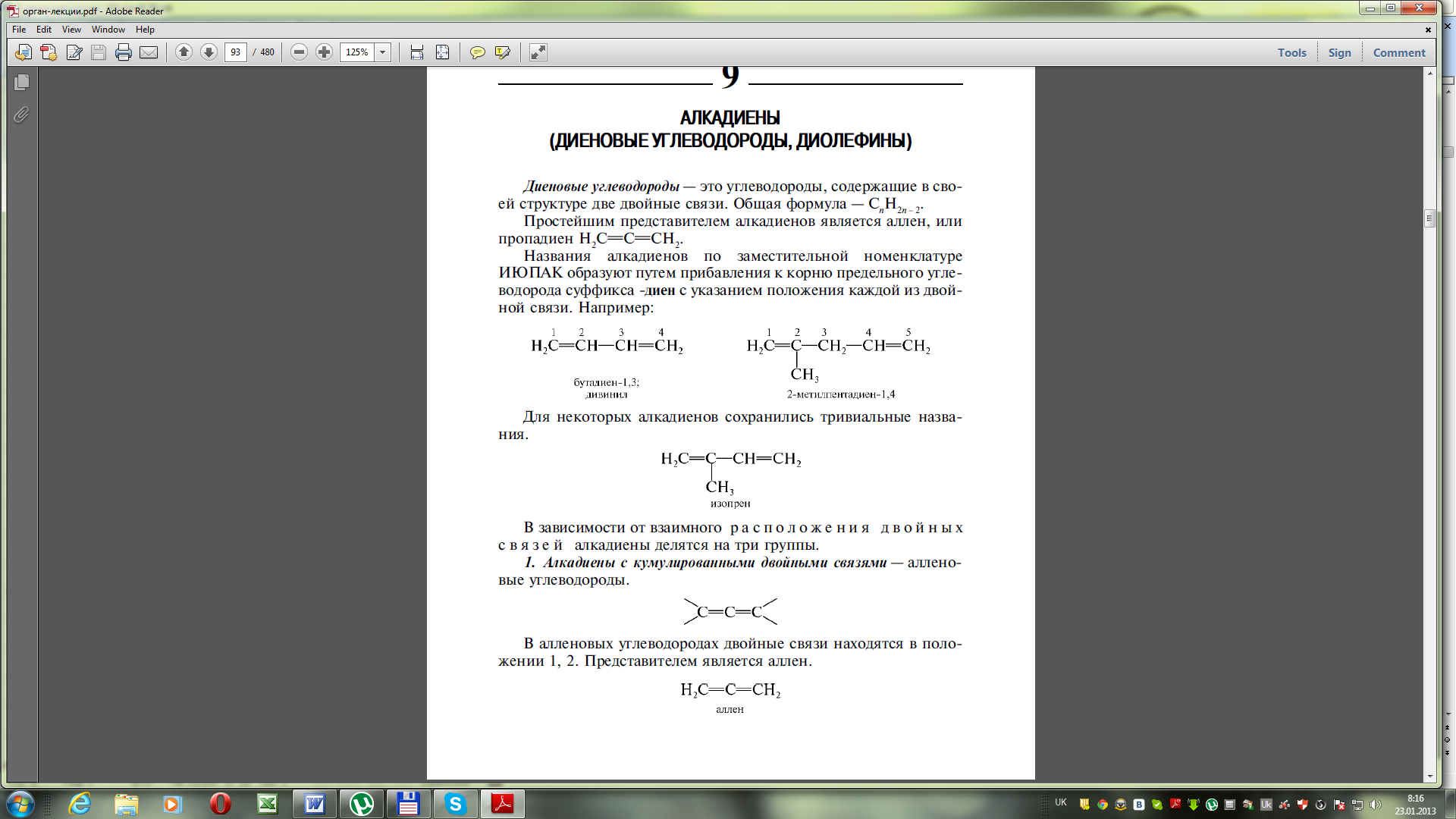
Для деяких алкадієнів зберіглись тривіальні назви:
Ізомерія алкадієнів.
Карбонового скелету
СН2=СН-СН2-СН=СН2 і СН2=С-СН=СН2
СН3
Пентадієн-1,4 2-метлбутадієн-1,3
Взаємного положення подвійних зв’язків
СН2=СН-СН2-СН=СН2 і СН2=СН-СН=СН-СН3
Пентадієн-1,4 пентадієн-1,3
Міжкласова (ізомерні алкінам)
СН2=СН-СН=СН2 і СНС-СН2-СН3
Бутадієн-1,3 бутин
Геометрична (цис-,транс-)
 Н Н
Н Н
Н2С = С Н2С = С
 Н
Н
С С = СН2
║

 С Н
С Н
Н Н
цис-бутадієн-1,3 транс-бутадієн-1,3
Будова алкадієнів
Кумулени розглянемо на прикладі алену СН2=С=СН2
Центральний атом Карбону знаходиться в стані sp-гібридизації, а атоми Карбону метиленових груп – в sp2-гібридизації. Всі три атоми Карбону розміщені в просторі лінійно, а -звязки знаходяться у двох взаємно перпендикулярних площинах.

