
- •Будова алкенів, стан гібридизації атому Карбону
- •Гомологічний ряд алкенів – СnH2n
- •Етеніл (вініл) Ізомерія алкенів
- •Старшинство замісників біля хірального центра
- •Фізичні властивості
- •Хімічні властивості
- •1) Гідрування, гідрогенізація (приєднання водню)
- •2) Галогенування (приєднання галогенів) – ае-приєднання.
- •3) Гідрогалогенування (приєднання гідрогалогенводнів)
- •Іі. Реакції окиснення
- •Ііі. Реакції полімеризації
- •Будова алкадієнів
- •У спряжених дієнів відбувається додаткове перекривання р-електронних хмар сусідніх -звязків (,-спряження) та утворюється єдина -електронна система. Наприклад, у бутадієну-1,3:
- •І.Реакції приєднання
- •Іі. Реакція полімеризації
- •Iіі. Реакції заміщення
- •V. Полімеризація алкінів.
- •2. Поліетилен високої щільності (hdpe)
- •3. Полівінілхлорид (pvc / V)
- •4. Поліетилен низької щільності (ldpe)
- •5. Поліпропілен (pp)
- •6. Полістирол (ps)
- •7. Інші види пластмас
1) Гідрування, гідрогенізація (приєднання водню)
При цьому подвійний зв’язок С=С розривається і утворюється простий зв’язок С—С, а алкени перетворюються на алкани. Каталізаторами реакції є платина, паладій або нікель:
Н2С=СН2 + Н2 = Н3С—СН3 + Q
Вирішальну роль відіграє просторовий чинник. Для розгалужених алкенів гідрування проходить тим легше, чим менше замісників розташовані біля подвійного зв’язку (правило Лебєдєва).
Стабільність алкенів зменшується в ряду:

Тобто найстабільнішим є 2-метилбутен-2, а найменш стабільним – етилен.
Реакції електрофільного приєднання (АЕ): галогенування, гідрогенгалогенування, гідратації.
2) Галогенування (приєднання галогенів) – ае-приєднання.
Н2С=СН2 + Br2 = H2C—CH2
│ │
Cl Cl
1,2-дихлоретан
В результаті утворюються віцинальні дагалогенпохідні алканів. Реакційна здатність галогенів різко зменшується в ряду: F2 > Cl2 > Br2 > I2.
Н2С=СН2 + Cl2 = H2C—CH2
│ │
Br Br
1,2-диброметан
Дана реакція є якісною реакцією на сполуки, що містять подвійний звязок (знебарвлення бромної води).
Напрямок реакції галогенування може змінюватись в залежності від умов. Так, алкени при нагріванні, дії УФО вступають в реакції вільнорадикального заміщення. При цьому атом гідрогену у атома карбону в -положенні до подвійного звязку заміщується на галоген. Таке заміщення має назву алільного (аномлаьне хлорування):
![]()
алілхлорид (3-хлорпропен-1)
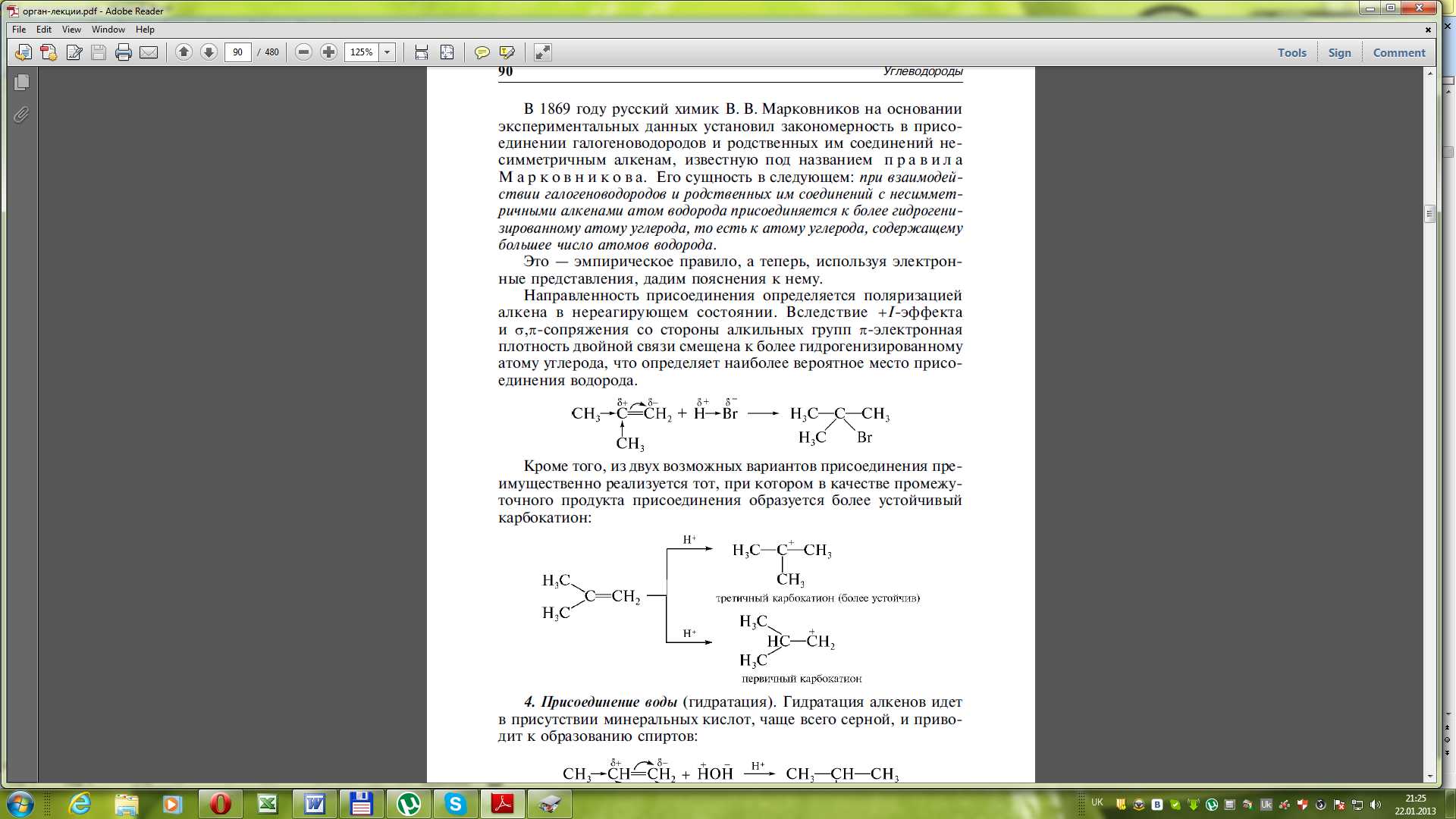
3) Гідрогалогенування (приєднання гідрогалогенводнів)
Реакційна здатність зменшується в ряду: HI > HBr > HCl > HF.
Приєднання до несиметричних алкенів відбувається за правилом Марковникова: атом Гідрогену приєднуєься до більш гідрогенізованого атому Карбону подвійного звязку (тобто до того атому Карбону, біля якого існує більше атомів Гідрогену).
Приєднання за правилом Марковнікова може бути пояснено поляризацією алкену під дією електронодонорних ефектів замісників (+І-ефекту та ефекту надспряження):
Правило Марковникова не виконується при розміщенні біля подвійного зв’язку електроноакцепторних груп (Х = -CN, -NO2, -CRO, -CF3), що пояснюється протилежним впливом таких замісників:
![]()
Гідратація – приєднання води відбувається в присутності мінеральних кислот (сульфатної) за правилом Марковникова з утворенням спиртів:

Механізм реакції наступний:
Іі. Реакції окиснення
розчином калій перманганату (реакція Вагнера) – гідроксилювання – введення груп –ОН, при цьому утворюються двохатомні спирти (гліколі):

Це якісна реакція на кратний звязок – знебарвлення розчину калію перманганату.
2) газофазне окиснення киснем повітря над срібним каталізатором з утворенням органічних оксидів (оксиранів):

3) окиснення з розривом молекули за місцем подвійного зв’язку з утворенням кетонів, альдегідів і карбонових кислот (при більш високій Т˚ і при більшій концентрації калію перманганату, інших окисниках – хром (VI) оксид, калію дихромат, нітратна кислота):
4) Озонування: реакція відбувається за подвійним зв’язком з утворенням пероксидних сполук – озонідів, які руйнуються з утворенням альдегідів і кетонів в залежності від будови алкену:

