
- •Будова алкенів, стан гібридизації атому Карбону
- •Гомологічний ряд алкенів – СnH2n
- •Етеніл (вініл) Ізомерія алкенів
- •Старшинство замісників біля хірального центра
- •Фізичні властивості
- •Хімічні властивості
- •1) Гідрування, гідрогенізація (приєднання водню)
- •2) Галогенування (приєднання галогенів) – ае-приєднання.
- •3) Гідрогалогенування (приєднання гідрогалогенводнів)
- •Іі. Реакції окиснення
- •Ііі. Реакції полімеризації
- •Будова алкадієнів
- •У спряжених дієнів відбувається додаткове перекривання р-електронних хмар сусідніх -звязків (,-спряження) та утворюється єдина -електронна система. Наприклад, у бутадієну-1,3:
- •І.Реакції приєднання
- •Іі. Реакція полімеризації
- •Iіі. Реакції заміщення
- •V. Полімеризація алкінів.
- •2. Поліетилен високої щільності (hdpe)
- •3. Полівінілхлорид (pvc / V)
- •4. Поліетилен низької щільності (ldpe)
- •5. Поліпропілен (pp)
- •6. Полістирол (ps)
- •7. Інші види пластмас
Л Е К Ц І Я № 3
ТЕМА: Ненасичені вуглеводні.
План
Алкени. Будова та конфігурація sp2-гібридного атома Карбону. Утворення та характеристика π-зв’язку. Гомологічний ряд. Номенклатура, ізомерія. Фізичні властивості алкенів. Хімічні властивості. Реакції електрофільного приєднання (АЕ): галогенування, гідрогенгалогенування, гідратації. Правило Марковникова та його сучасна інтерпретація. Окиснення алкенів, реакція Вагнера. Полімеризація алкенів.
Поняття про високомолекулярні сполуки. Поліетилен. (самостійно)
Алкадієни. Типи дієнів (кумульовані, спряжені, ізольовані). Будова. Номенклатура. Спряжені дієни. Особливості реакцій електрофільного приєднання (АЕ) (галогенування, гідрогенгалогенування). Полімеризація 1,3-дієнів (бутадієн, ізопрен).
Алкіни. Будова потрійного зв’язку. Конфігурація sp-гібридного атома Карбону. Гомологічний ряд. Номенклатура та ізомерія алкінів. Фізичні властивості. Хімічні властивості. Реакції електрофільного приєднання (АЕ): галогенування, гідрогенгалогенування, гідратації (реакція Кучерова). Правило Ельтекова. Реакція заміщення. СН-Кислотний характер алкінів. Окиснення та відновлення алкінів. Димеризація і циклотримеризація ацетилену.
Ідентифікація ненасичених вуглеводнів. (самостійно)
Застосування окремих представників у фармації та медицині. (самостійно)
Ненасиченими називаються вуглеводні, у молекулах яких між атомами Карбону є кратні (подвійні або потрійні) зв'язки, а всі інші валентності насичені атомами Гідрогену.
Залежно від кількості та характеру кратних зв’язків ненасичені вуглеводні класифікують на такі ряди:
Алкени (етиленові вуглеводні) – СnH2n.
Алкадієни (дієнові) – СnH2n-2.
Алкіни (ацетиленові) - СnH2n-2.
Ми сьогодні будемо вивчати алкени (вуглеводні ряду етилену) – це вуглеводні, які у своєму складі містять один подвійний зв’язок С=С. Загальна формула СnH2n. Історично першою назвою аліфатичних вуглеводнів із подвійним звязком була назви «олефіни» - «маслоутворювальні», оскільки під час взаємодії з хлором або бромом утворювались маслянисті рідини.
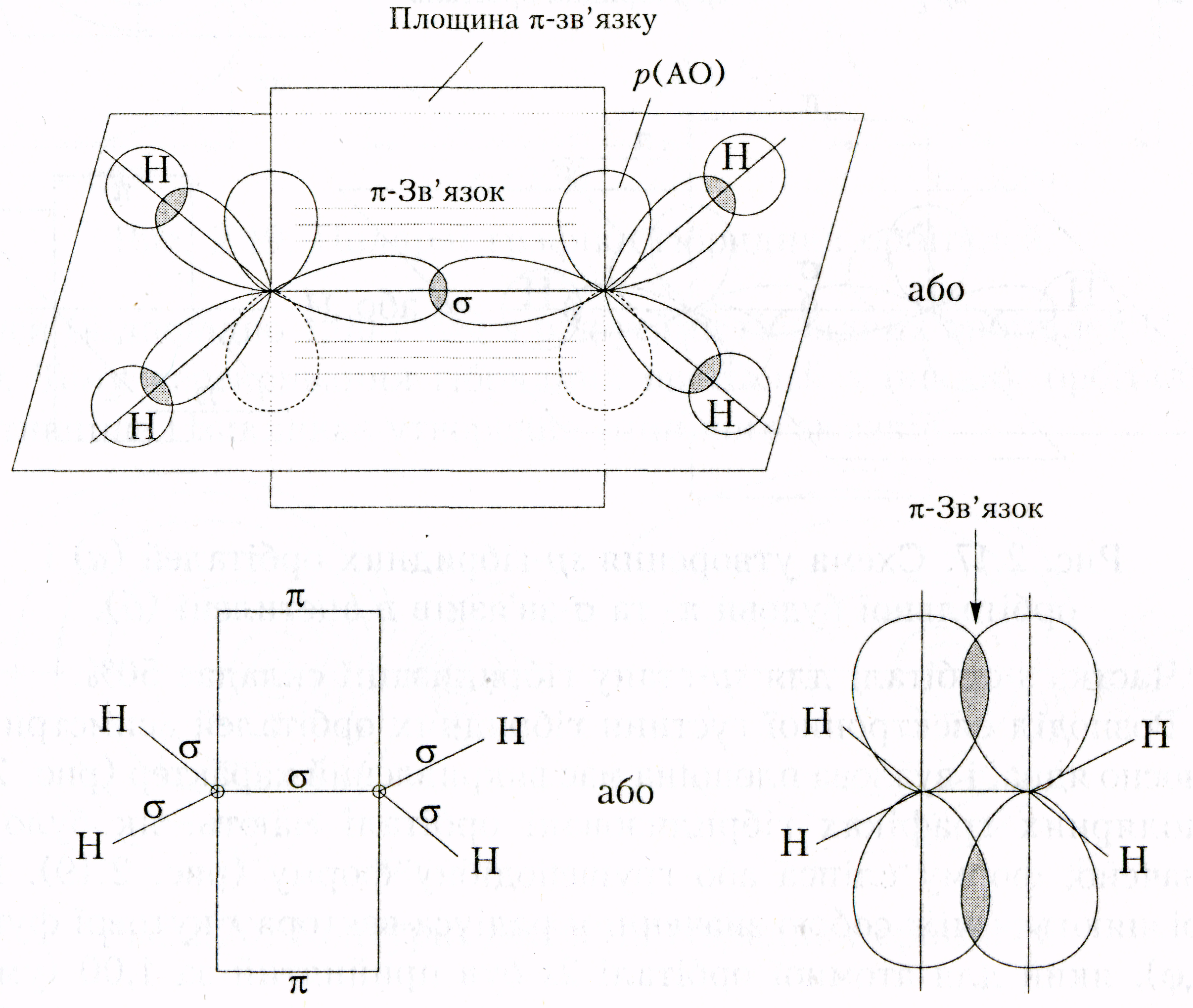
Будова алкенів, стан гібридизації атому Карбону
Розглянемо будову алкенів на прикладі етилену: Н2С=СН2
sp2-гібридизація атома Карбону (другий валентний стан) – відбувається змішуванням трьох орбіталей (s+p+p), а одна 2p-АО залишається в негібридному стані.

Осі трьох sp2 -гібридних орбіталей розміщені в одній площині під кутом 120 (тригональна гібридизація). Негібридизовані р-АО двох атомів Карбону розташовані паралельно одна одній і перпендикулярно до цієї площини. Зв’язок, утворений паралельними (бічними) перекриванням найчастіше р-орбіталей вздовж площини, що проходить крізь ядра двох атомів, називається π-зв’язок. Довжина його 0,134нм.
Назви алкенів утворюються з назв відповідних алканів заміною суфіксу –ан на суфікс –ен, який і вказує на наявність в молекулі подвійного зв’язку.
Гомологічний ряд алкенів – СnH2n
-
Алкани
Алкени
Назва
Формула
Назва
Формула
Метан
СН4
-
-
Етан
С2Н6
Етен (етилен)
С2Н4
Пропан
С3Н8
Пропен (пропілен)
С3Н6
Бутан
С4Н10
Бутен (бутілен)
С4Н8
Пентан
С5Н12
Пентен
С5Н10
Гексан
С6Н14
Гексен
С6Н12
Гептан
С7Н16
Гептен
С7Н14
Октан
С8Н18
Октен
С8Н16
В алкенах нумерацію карбонового ланцюгу починають з того кінця, ближче до якого знаходиться подвійний зв’язок.
СН2 = СН – СН2 – СН3 – бутен –1
Іноді використовують раціональну номенклатуру, за якою вуглеводень розглядають як похідний етилену, в молекулі якого атоми гідрогену заміщені на радікали:
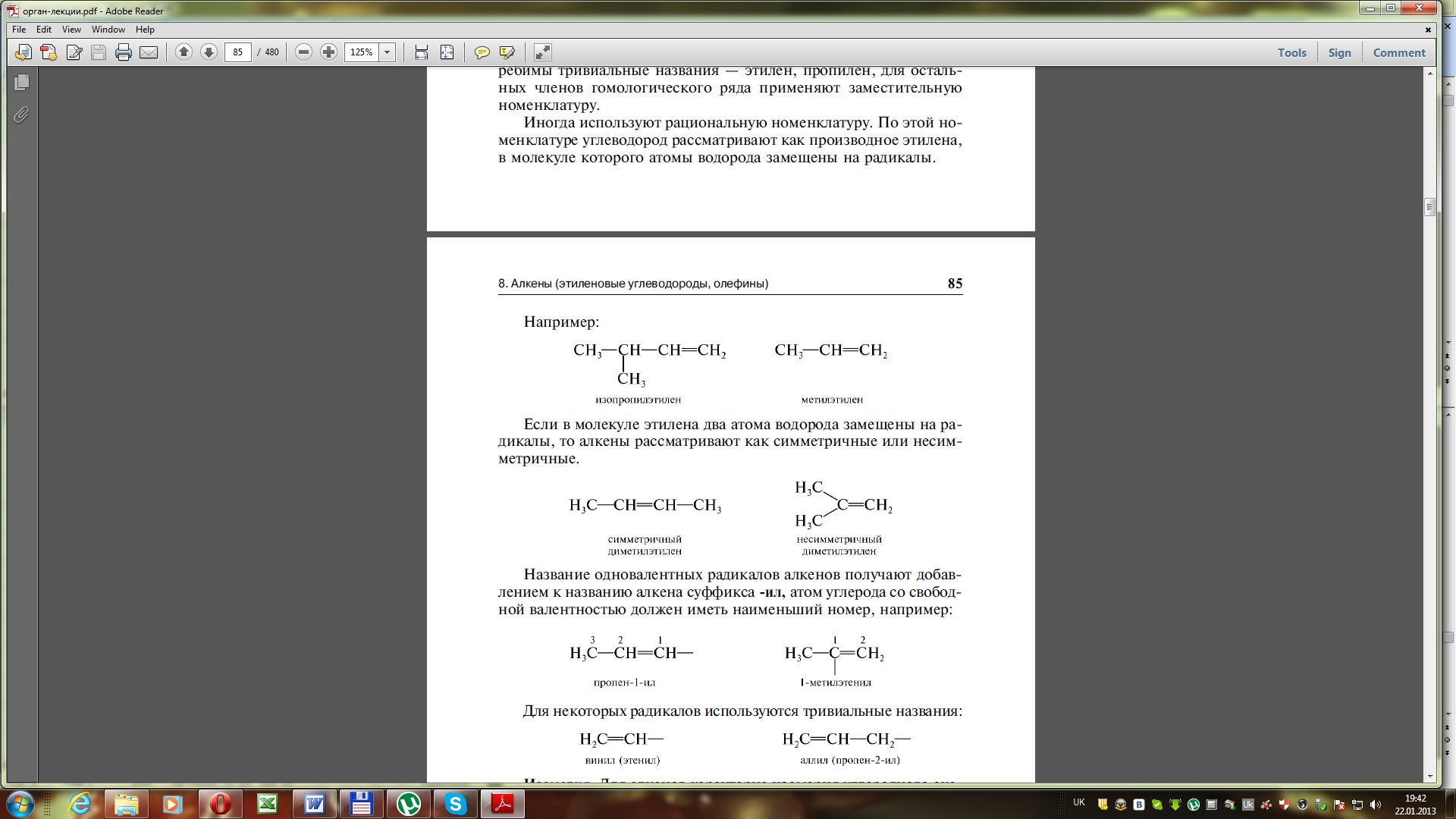
ізопропілетилен метилетилен
Якщо в молекулі етилену два атоми Гідрогену заміщені на радикали, то лакени розглядаються як симетричні або несиметричні:
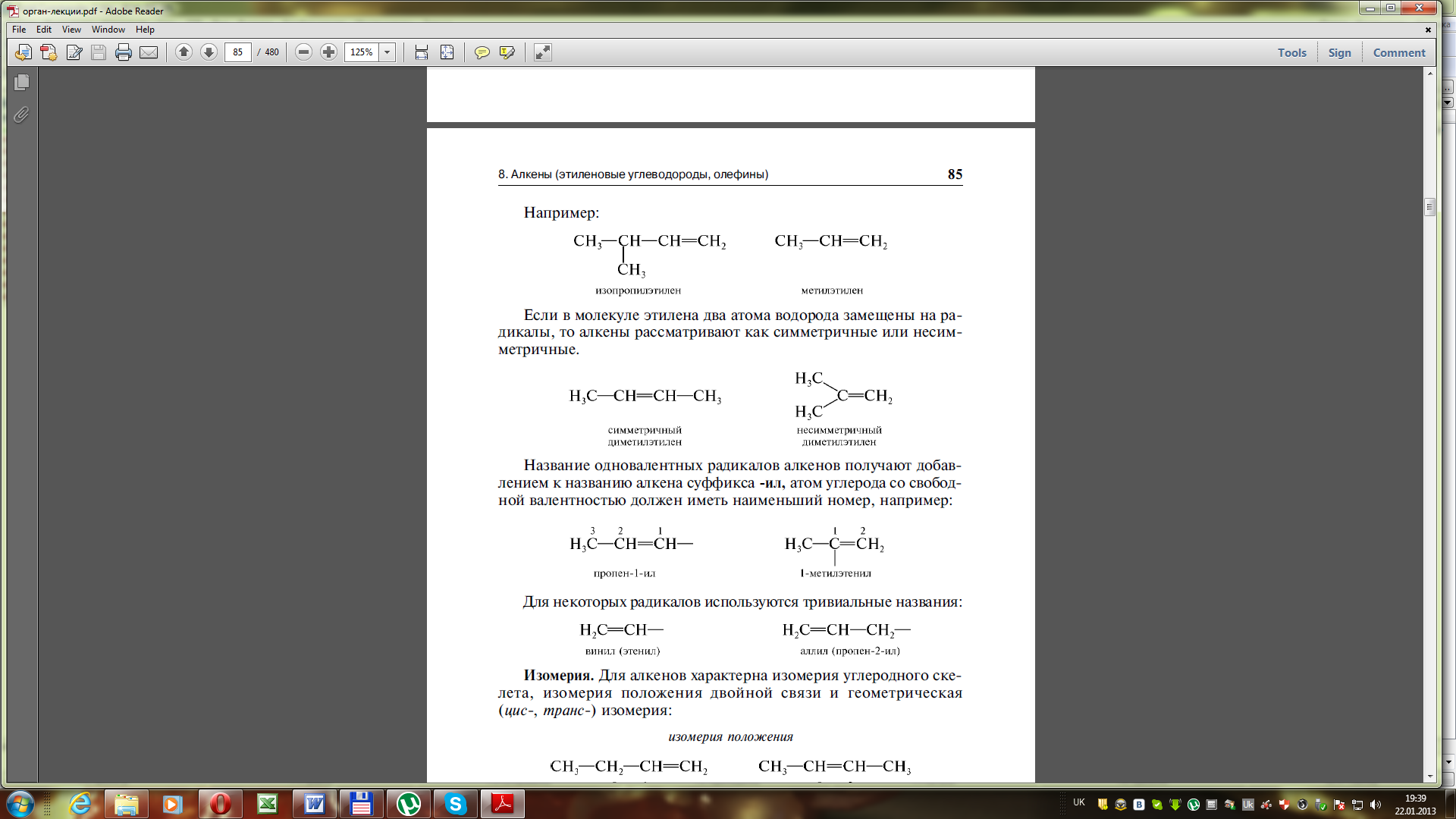
симетричний диметилетилен несиметричний диметилетилен
назви одновалентних неначисених радикалів отримують додаванням до назви алкену суфіксу –іл, атом Карбону із вільною валентністю повинен мати найменший номер при нумерації:
пропеніл-1 (пропен-1-іл)
пропеніл-2 (пропен-2-іл), аліл
Етеніл (вініл) Ізомерія алкенів
Структурна
А) Карбонового скелету
СН2 = С – СН2 – СН3 2-метилбутен –1
СН3
СН2 = СН – СН - СН3 3-метилбутен-1
СН3
Б) Положення подвійного зв’язку
СН2 = СН – СН2 – СН3 – бутен –1
СН3 – СН = СН - СН3 – бутен-2
Геометрична (цис-,транс)

Але якщо кількість замісників зростає до трьох або чотирьох, користуються універсальнішою номенклатурою Z, E-номенклатурою. В основу Z, E-позначення покладено принцип старшинства (пріоритетності). Старшинство замісників збільшується із збільшенням атомного номера елемента, який безпосередньо зв’язаний з хіральним атомом – центром (атом С, який сполучений із чотирьма різними замісниками), тобто з атомом Карбону зв’язку С=С. Так, старшинство замісників збільшується в ряду:
