
- •Билет№2
- •Закон Генри записывается обычно следущим образом:
- •2)Алюми́ний — элемент главной подгруппы третьей группы третьего периода периодической системы химических элементов д. И. Менделеева, с атомным номером 13.
- •Способы смещения равновесия в реакциях гидролиза
- •Билет№11. Окислительно-восстановительные реакции
- •Электролиз расплавов.
- •1)Противокоррозионной защитой (защитой от коррозии) называют процессы или средства, применяемые для уменьшения или прекращения коррозии металла.:
- •2) Подгруппа хрома.Оксиды, гидроксиды и соли хрома, их кислотно-основные и окислительно-восстановительные свойства. Записать и уравнять реакцию взаимодействия бихромата калия с соляной кислотой.
- •2) Триада железа – железо, кобольт и никель
- •Стандартные энтропии некоторых веществ.
- •2. Атом состоит из положительно заряженного ядра, занимающего малый объем, и отрицательно заряженных легких частиц – электронов
- •Общая формула
Способы смещения равновесия в реакциях гидролиза
1) Убрать избыток ионов ОН- (Н+), добавляя кислоту (или, соответственно, основание).
2) Убрать избыток ионов ОН- (Н+), добавляя соль, которая гидролизуется с образованием ионов Н+ (ОН-).
3) Увеличить температуру раствора, т.к. все реакции гидролиза солей – реакции эндотермические. Нагретый раствор ацетата натрия, например, пахнет уксусной кислотой.
4) Разбавить раствор. Чем более разбавлен раствор, тем в большей степени гидролизована в нем соль.
Применяя к этому обратимому процессу закон действующих масс, запишем выражения для скоростей прямой и обратной реакций:
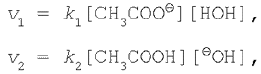
где k1 и k2 – константы скорости прямой и обратной реакций соответственно.
Как и любой другой обратимый процесс, реакция гидролиза заканчивается установлением химического равновесия, т. е. такого состояния системы, когда скорости прямой и обратной реакций равны: v1 = v2.
Откуда
Константа химического равновесия К равна отношению константы скорости прямой реакции к константе скорости обратной реакции.
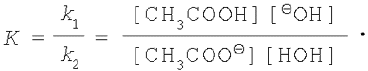
Концентрацию воды в растворе допускается считать величиной постоянной, поэтому объединим [НОН] и К.
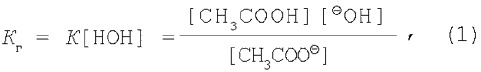
где Кг – константа гидролиза.
Билет№10. Перевод равновесной химической системы из одного состояния равновесия в другое называется смещением (сдвигом) химического равновесия, которое осуществляется изменением термодинамических параметров системы - температуры, концентрации, давления При смещении равновесия в прямом направлении достигается увеличение выхода продуктов, а при смещении в обратном направлении - уменьшение степени превращения реагента. И то, и другое может оказаться полезным в химической технологии.
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
Фосфор (Р) - Один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Оксид фосфора (3) - кислотный оксид, при взаимодействии с холодной водой образует фосфористую кислоту:
P2O3 + 3H2O = 2H3PO3 Ортофосфорную кислоту получают в промышленности двумя способами.
Билет№11. Окислительно-восстановительные реакции
в организме, биохимические процессы, при которых происходит перенос электрона или атома водорода (иногда с сопровождающими его атомами или группами) от одной молекулы (окисляемой) к другой (восстанавливаемой). Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электростатического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов..
Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный.
Кислород — химически активный неметалл, является самым лёгким элементом. Простое вещество кислород.
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры.Пример реакций, протекающих при комнатной температуре
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
Оксиды 2BaO+O2-2Ba+O2
Билет№12. Чистое металлическое железо устойчиво в воде, однако все же реагирует с ней 3Fe+4H2O=3Fe3O4+4H2O Железо практически не растворяется в щелочах. А концентрированная серная и азотная кислоты пассивируют железо. Однако с разбавленными Fe реагирует: Fe+H2SO4=FeSO4+H2 Fe+HNO3=Fe(NO3)3+NO+2H2O Железо реагирует с уксусной кислотой: 2CH3COOH+Fe=(CH3COO)2Fe+H2
Се́ра - элемент 6-й группы (по устаревшей классификации — главной подгруппы VI группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. Sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Электронная формула атома - [10Ne]3s23p4.
Степени окисления серы - +6, +4, +2, 0, -1, −2.
Валентность серы – IV.
Билет№13. Гальвани́ческий элеме́нт — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита.
Водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
ЭЛЕКТРОХИМИЧЕСКИЙ
РЯД НАПРЯЖЕНИЙ,
последовательность расположения
электродов в порядке возрастания их
стандартных электродных потенциалов
(см. Стандартный потенциал). Металлич.
электроды в водном р-ре электролита
образуют след. Э.
р.
н.:
Li, К,
Rb, Ba, Sr, Ca, Na, Се,
Mg, Be, Al, Ti, Mn, V, Zn, Cr, Ga, Fe, Cd, In, Tl, Co, Ni, Sn, Pb,
H2, Bi, Cu, Hg, Ag, Pt, O2, Au. Ддя
сравнения включены водородный электрод
(Pt, H2[l атм] | Н+ ), потенциал к-рого при
давлении водорода 1,01 x 105 Па и термодинамич.
активности а ионов Н+ в водном р-ре,
равной 1, при всех т-рах принимается
равным нулю (потенциалопределяющая
р-ция Н+ + е![]() 1/2Н2,
где е - электрон) и кислородный электрод
(потенциалопределяющая р-ция О2 + 2Н2О +
4е
1/2Н2,
где е - электрон) и кислородный электрод
(потенциалопределяющая р-ция О2 + 2Н2О +
4е![]() 4ОН-)
4ОН-)
Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента.
уравнением
Нернста -![]()
Фтор — при нормальных условиях — двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Очень ядовит.
Пла́виковая кислота́ (фтороводоро́дная кислота́) — водный раствор фтороводорода (HF). Промышленностью выпускается в виде 40 % (чаще), а также 50 % и 72 % растворов. Название «плавиковая кислота» происходит от плавикового шпата, из которого получают фтороводород.
Билет№14. Электролиз водных растворов.
Может проходить как без участия, так и с участием молекул воды, в которой растворен электролит. В качестве примера рассмотрим:
а) электролиз водного раствора хлорида меди (II) – CuCl2.
Демонстрация опыта. Что мы наблюдаем? На катоде (–) осаждается чистая медь, на аноде (+) выделяется газ желто-зеленого цвета с резким запахом – это хлор.
В водном растворе CuCl2 диссоциирует на ионы: СuCl2 ↔ Cu2+, + 2Cl-
К катоду движется катион меди, принимает два электрона, то есть восстанавливается с образованием меди. К аноду движется хлорид-анион, отдает свой электрон, то есть окисляется с образование атомов, а затем и молекул хлора.
В виде химических уравнений процесс записывается так:
Электролиз раствора соли CuCl2:
CuCl2 ↔ Cu2+ + 2Cl-
Катод (–) Анод (+)
Cu2+ + 2ē → Cu0 Cl- – 1ē → Cl0
2Cl0 → Cl2 ↑
электролиз
CuCl2 ===== Cu + Cl2 ↑
