
- •Тесты по разделу «Химическая связь»
- •3) Металлическая
- •3) Металлический
- •Тесты к разделу “ Металлы “
- •1) Амфотерные свойства
- •2) Основные свойства
- •3) Кислотные свойства
- •3) Восстановительные свойства
- •4) Основные свойства
- •5) Амфотерные свойства
- •Тесты по разделу «Металлы и электрохимический ряд напряжений металлов» .
- •1 Моль/л
- •Различной смачиваемости минералов
- •Тесты по разделу «Строение атома и периодическая система д.И.Менделеева».
- •Дополнение Общая и неорганическая химия
- •Серебро;
- •Ионная;
- •Металлическая.
- •Тесты по разделу «Электрохимия»
- •1)Деполяризацией
- •Тесты по разделу «Химическая термодинамика»
- •5)Серная кислота
- •Тесты по разделу «Растворы»
- •2) 24,5 Г кислоты
- •2)Хлорид калия
- •4)Сульфид натрия
Соединение, в котором углерод имеет степень окисления - 4:
CO2;
CCl4;
+CH4;
H2CO3.
Соединение, в котором азот имеет степень окисления + 3:
Cu(NO3)2;
NH4Cl;
N2O5;
+Ca(NO2)2.
Кислород проявляет положительную степень окисления в соединении:
NaNO2;
KNO3;
H2O2;
+OF2.
Водород проявляет отрицательную степень окисления в соединении:
HCl;
H2O;
+NaH;
NaOH.
Степень окисления свинца одинакова в ряду:
PbCl4, Na2[Pb(OH)6], PbO;
+Pb(NO3)2, PbO, Na2[Pb(OH)4];
Pb(OH)2, PbI2, Pb;
PbO2, Pb(CH3COO)2, Pb(OH)2 .
Соль, которой соответствует название "гидрокарбонат железа (II)":
Fe(HCO3)3;
+Fe(HCO3)2;
FeOHCO3;
(FeOH)2CO3.
Соль, которой соответствует название "дигидроксосульфит алюминия":
(Al(OH)2)2SO4;
AlOHSO4;
Al(HSO3)3;
+(Al(OH)2)2SO3.
Некоторый элемент Z образует хлорид состава ZCl5. Наиболее вероятная формула его оксида:
ZO2;
ZO5;
+Z2O5;
Z5O2.
Оксид, образующий кислоту типа Н2ЭО3:
SO3;
+CO2;
NO;
P2O5.
Даны простые вещества: сажа, озон, графит, кислород, алмаз, красный фосфор. Всего в состав этих веществ входит следующее количество химических элементов:
6;
+3;
4;
5.
Массовая доля водорода будет наименьшей в соединении:
CH4;
C2H4;
+C6H6;
C2H6 .
Ядовитый газ фосген имеет следующий элементный состав в массовых долях (%): C - 12,1; O - 16,2; Cl - 71,7. Его формула ___________ . COCl2
Оксид содержит 70,0 % железа. Формула этого оксида _________. Fe2O3
Атом кальция имеет электронную конфигурацию:
1s22s22p63s23p64d2;
1s22s22p63s2;
+1s22s22p63s23p64s2;
1s22s22p63s23p63d104s2 .
Ион Al3+ имеет электронную конфигурацию:
1s2;
+1s22s22p6;
1s22s22p63s23p1;
1s22s22p63s2.
Количество электронов, находящихся на внешнем энергетическом уровне атома кислорода: ___________ (впишите число). 6
К какому семейству элементов относится алюминий:
к семейству s-элементов;
+к семейству p-элементов;
к семейству d-элементов;
к семейству f-элементов.
Из атомов двух элементов: водорода и гелия - меньший радиус имеет
атом водорода;
+атом гелия;
размеры этих атомов одинаковы.
Электроотрицательность возрастает в ряду:
+Te, Se, S, O;
Cl, F, S, O;
P, Si, S, O;
O, S, Se, Te.
Атомы изотопов одного элемента отличаются
числом протонов;
+числом нейтронов;
числом электронов;
зарядом ядра.
Изотоп одного из элементов не содержит нейтронов. Речь идет о химическом элементе ___________ (впишите формулу). H
В частице Na+ содержится ________ протонов (впишите количество протонов). 11
Молекула с неполярной ковалентной связью:
+I2;
CO2;
HBr;
NH3.
В ряду молекул HCl - HBr - HI полярность ковалентной связи
усиливается;
+уменьшается;
сначала усиливается, затем уменьшается;
остается практически неизменной.
Основная причина того, что температура кипения воды выше, чем температуры кипения сероводорода, теллуроводорода:
меньший радиус атома кислорода;
отсутствие d-орбиталей у атома кислорода;
+наличие сильных водородных связей между молекулами воды;
меньшая молекулярная масса воды.
Тип гибридизации центрального атома и геометрическая форма молекулы аммиака:
sp2, треугольник;
+sp3, тригональная пирамида;
sp3, тетраэдр;
sp2, тригональная пирамида.
Сравните плотность воды в жидком состоянии (dжид.) и в твердом состоянии (dтв.):
+dжид. > dтв.;
dжид. < dтв.;
dжид. = dтв..
Ионную кристаллическую решетку имеет
+фторид натрия;
вода;
Серебро;
бром.
Молекулярную кристаллическую решетку имеет
алюминий;
+оксид серы (IV);
хлорид калия;
графит.
Кристаллическая решетка алмаза
Ионная;
+атомная;
молекулярная;
Металлическая.
Наибольшее число молекул содержится при обычных условиях в 1 литре
сероводорода;
+воды;
водорода;
кислорода.
Ацетилен объемом 67,2 л при н.у. составляет следующее количество вещества:
6 моль;
2 моль;
2,5 моль;
+3 моль.
Неверное утверждение:
водород не имеет запаха;
+водород хорошо растворим в воде;
водород легче воздуха;
водород - бесцветный газ.
Несолеобразующим является оксид:
Al2O3;
CO2;
+N2O;
Fe2O3.
В ряду находятся только кислотные оксиды:
Na2O, CaO, CO2;
SO3, CuO, CrO3;
+SO3, CO2, P2O5;
SiO2, CO2, N2O .
Вещество, которое при растворении в воде дает слабощелочную реакцию:
NO2;
H2S;
CO2;
+NH3.
Характер оксидов в ряду MnO - Mn2O3 - MnO2 - MnO3 - Mn2O7 изменяется
от кислотного к основному;
от основного к амфотерному;
+от основного к кислотному;
все оксиды имеют примерно одинаковые свойства.
Реакция 3Fe + 2O2 Fe3O4 относится к реакциям
замещения;
обмена;
+соединения;
разложения.
Реакция H2SO4 + 2NaOH Na2SO4 + 2H2O называется реакцией
окисления - восстановления;
гидролиза;
осаждения;
+нейтрализации.
Реакцией замещения является
3Fe + 2O2 Fe3O4;
+Fe + 2HCl FeCl2 + H2;
2Fe + 3Cl2 2FeCl3;
FeCl3 + 3AgNO3 Fe(NO3)3 + 3AgCl.
Не является электролитом
водный раствор серной кислоты;
расплав гидроксида натрия;
водный раствор сульфата меди (II);
+жидкий кислород.
Кристаллогидратами называются
+твердые вещества, в состав которых входит химически связанная вода;
твердые вещества, растворимые в воде;
твердые вещества, реагирующие с водой;
твердые вещества, не растворимые в воде.
Реакция, в которой окисляется водород:
+CuO + H2 = Cu + H2O;
2Na + H2 = 2NaH;
Mg + H2SO4 = MgSO4 + H2;

Галоген, в наибольшей степени проявляющий окислительные свойства: __________ (впишите формулу простого вещества). F2
В ряду увеличивается восстановительная способность галогенидов:
KCl, KBr, KI, KF;
KI, KBr, KCl, KF;
KF, KI, KBr, KCl;
+KF, KCl, KBr, KI.
Причина того, что алюминий не подвергается коррозии:
химически малоактивен;
пассивируется в концентрированных H2SO4 и HNO3;
взаимодействует со щелочами;
+покрыт защитной оксидной пленкой.
Опаснее всего подносить огонь к сосуду, в котором находится
азот;
кислород;
+смесь водорода с кислородом;
водород.
Верное утверждение:
кислород имеет запах;
кислород хорошо растворим в воде;
кислород проводит электрический ток;
+кислород тяжелее воздуха.
Вещество, не взаимодействующее с оксидом фосфора (V):
+оксид углерода (IV);
оксид кальция;
гидроксид калия;
вода.
Реакция, с помощью которой нельзя получить оксид цинка:
+Zn + HCl




В уравнении реакции K2O + ZnO ; : сумма коэффициентов равна
+3;
4;
5;
6.
В уравнении реакции SO3 + Al2O3 : сумма коэффициентов равна
3;
4;
+5;
6.
Водород в промышленности получают следующим способом:
действием кислот на активные металлы;
разделением воздуха;
+конверсией метана;
перегонкой нефти.
Для осушки аммиака его надо пропустить через
P2O5;
H2SO4 конц.;
+NaOH;
CuSO4.
Качественный состав хлорида железа (III) можно установить, используя два раствора, содержащие соответственно ионы
+CNS- и Ag+;
OH- и Ba2+;
CNS- и Ba2+;
OH- и H+.
Состав соли (NH4)2SO4 можно установить, используя два раствора, содержащие соответственно ионы
+OH- и Ba2+;
OH- и H+;
Cl- и Cu2+;
CO32- и Ba2+.
Реакция, являющаяся качественной на ион SO42-:
SO3 + Ca(OH)2 = CaSO4 + H2O;
CuSO4 + Ni = NiSO4 + Cu;
+Na2SO4 + BaCl2 = BaSO4 + 2NaCl;
3Na2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6NaOH.
Имеются газы: H2S, Cl2, SO2, CO2. Реактив, являющийся лучшим поглотителем всех этих газов:
H2O;
раствор HCl;
H2SO4;
+NaOH.
Выделение водорода будет наблюдаться в реакции:
Cu + H2SO4 (конц.)
+Fe + H2SO4 (разб.)
Cu + HNO3 (конц.)
Fe + HNO3 (разб.) .
Ряд, в котором все вещества при добавлении воды образуют щелочи:
+Na2O, Li, CaO, K;
Fe2O3, Li, CaO, Na;
Al2O3, CO2, Li, Fe2O3;
CaO, Na2O, Al2O3, Ca.
Ряд, в котором каждое из веществ образует с раствором щелочи осадок малорастворимого основания:
NaCl, FeCl3, Al2(SO4)3;
NH4Cl, CuSO4, MnCl2;
KNO3, Na2SO4, Cr(NO3)3;
+CuSO4, FeCl3, Cr(NO3)3.
Ряд, в котором каждое из веществ реагирует с оксидом серы (IY):
H2O, SO3, NaCl;
+H2O, O2, CaO;
Na2O, SiO2, H3PO4;
H2O, CaO, HCl.
Ряд, в котором каждое из веществ реагирует с молекулярным водородом:
HCl, NaCl, KOH;
Fe2O3, KOH;
+Fe2O3, Cl2;
Fe2O3, KOH, Cl2.
Ряд, в котором каждое из веществ реагирует с хлороводородной кислотой:
Ca, H2, BaO;
Zn, H2O, BaSO4;
Al2O3, CO2, Cu;
+MgO, Na2CO3, Fe.
Ряд, в котором каждый из металлов реагирует с разбавленной серной кислотой:
Na, Ag, Ba;
+K, Ca, Ni;
Mg, Al, Pt;
Pb, Cr, Cu.
Ряд, в котором каждое из веществ взаимодействует с оксидом углерода (IV):
CaO, P2O5;
HCl, CaO;
NaCl, CaO;
+Na2O, NaOH.
Ряд, в котором каждое из веществ вступает в реакцию с водным раствором карбоната натрия:
+HNO3, CO2;
NaCl, CaCO3;
CO2, NaOH;
O2, Ba(NO3)2.
Ряд, в котором каждый из оксидов пригоден для использования в качестве осушителя (поглотителя воды):
CuO, P2O5;
BaO, CuO;
+P2O5, BaO;
Fe3O4, P2O5.
Ряд, в котором каждое из веществ можно использовать для получения кислорода лабораторным способом:
KMnO4, H2SO4, NaCl;
NaNO3, Ba(OH)2, Al2O3;
HgO, Ba(OH)2, NaNO3;
+KMnO4, H2O2, KClO3.
Ряд, в котором каждое из веществ несовместимо с присутствием озона:
SO2, CO2, H2S, HF;
SO2, H2S, H2, HF;
KJ, SO3, CO2, N2;
+SO2, H2S, KJ, N2.
На чашках весов уравновешены стаканчики с растворами гидроксида натрия и хлорида натрия. Через некоторое время стрелка весов

+отклонится влево;
отклонится вправо;
не изменит своего положения.
Вещество, с которым взаимодействует сульфид натрия с образованием PbS:
Pb;
PbO;
+Pb(NO3)2;
PbO2.
Реагент(ы), в реакции с которым(и) оксид азота (IV) образует только нитрат натрия и воду:
NaOH, Ca;
Na2S;
Na2SO4;
+NaOH, O2.
Продукты, образующиеся при термическом разложении нитрата меди (II):
Cu(OH)2, O2, N2;
+CuO, NO2, O2;
CuO, NO2;
Cu(NO3)2, O2.
Кислота, которую нельзя хранить ни в обычной посуде, ни в посуде из кварцевого стекла:
HNO3;
H2SiO3;
HBr;
+HF.
В трех пробирках находятся растворы хлорида калия, бромида калия и иодида калия. Реактив, с помощью которого можно распознать все соли:
H2SO4;
HCl;
+AgNO3;
AgCl.
В трех пробирках находятся концентрированные растворы кислот: H2SO4, HCl, HNO3. Реактив, с помощью которого можно распознать все кислоты:
BaCl2;
метиловый оранжевый;
+Zn;
AgNO3.
Смесь железа, меди и алюминия обработали концентрированной азотной кислотой на холоду. При этом растворились следующие металлы:
Fe, Cu;
Все металлы;
Fe, Al;
+Cu.
Масса стакана с концентрированной серной кислотой при длительном хранении
+увеличится;
уменьшится;
не изменится.
Из перечисленных процессов:
а) растворение концентрированной серной кислоты в воде;
б) испарение спирта;
д) разложение воды
в) гашение извести;
г) горение водорода;
к экзотермическим относятся
+а, в, г;
а, б, в, г, д;
б, д;
а, в, г, д.
В реакционной системе в равновесии находятся
![]() .
.
Чтобы сместить равновесие реакции вправо, необходимо
увеличить концентрацию CO2;
+увеличить давление в системе;
повысить температуру;
уменьшить концентрацию O2 .
Химическое равновесие в системе
![]()
сместится в сторону исходных веществ при
+понижении температуры;
повышении температуры;
повышении давления;
перемешивании.
Реакция, для которой повышение давления в системе приводит к увеличению выхода продукта реакции:
 ;
;
+
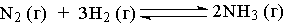 ;
;
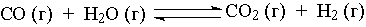 ;
;

В 200 мл воды растворили 25 г соли. Массовая доля соли в полученном растворе составляет
+11,1%;
12,5%;
50%;
1,25% .
При растворении кристаллогидрата CaCl2 · 6 H2O массой 219 г в 1000 г воды образовался раствор хлорида кальция с массовой долей
+9,1%;
17,9%;
21,9%;
43,8% .
Реакция, протекающая без изменения степеней окисления:
P + O2 ;
+CaO + H2O ;
Fe + H2SO4 ;
MnO2 + 4 HCl .
В реакции, протекающей по схеме Cr2S3 + KNO3 K2CrO4 + K2SO4 + NO, окислению подвергаются следующие элементы:
N, S;
+S, Cr;
Cr, N;
Cr, O .
Реакция, в которой фосфор выполняет роль окислителя:
4P + 5O2 = 2P2O5;
+P + 3K = K3P;
2PH3 + 4O2 = P2O5 + 3H2O;
2P + 5Cl2 = 2PCl5;
Реакция, протекающая практически до конца:
+CuSO4 + KOH ;
NaCl + KOH ;
CuSO4 + HCl ;
BaSO4 + HCl .
Реакция, которую можно использовать для получения гидроксида алюминия:
Al2O3 + H2O ;
+AlCl3 + NaOH (недостаток) ;
AlCl3 + NaOH (избыток) ;
Al + NaOH (избыток) .
Вещества, в водных растворах которых растворяется Al(OH)3:
+KOH, H2SO4;
NaOH, NaCl;
NaNO3, KCl;
H2SO4, K2SO4.
Из приведенных ниже солей гидролизу не подвергается
CuSO4;
Na2CO3;
CH3COONH4;
+KNO3 .
В водном растворе кислую реакцию среды имеет
CH3COONa;
+NH4Cl;
Na2CO3;
Na2HPO4 .
Ряд, в котором водный раствор каждого из указанных веществ имеет щелочную реакцию среды:
NaHCO3, NaCl;
+NaOH, K2CO3;
KNO3, KOH;
Na2SO4, Na2S.
Чтобы ослабить или прекратить гидролиз раствора хлорида железа (III), необходимо немного добавить
+соляной кислоты;
гидроксида калия;
твердой соли NaCl;
дистиллированной воды.
Вещество, которое выпадает в осадок при сливании концентрированных водных растворов Na2S и AlCl3:
Al2S3;
+Al(OH)3;
AlOHCl2;
NaCl .
При взаимодействии образца кристаллической соды массой 1,287 г с избытком хлороводородной кислоты выделилось 100,8 мл газа (н.у.). Формула кристаллогидрата имеет вид:
+Na2CO3 · 10 H2O;
Na2CO3 · 7 H2O;
Na2CO3 · H2O;
Na2CO3 .
При получении меди из сульфата меди (II) необходимо осуществить ряд превращений CuSO4 X Y Cu, промежуточными продуктами которых будут X __________ , Y ___________ (впишите формулы веществ). Cu(OH)2 CuO
Превращения
 можно
осуществить с помощью следующих
реагентов:
можно
осуществить с помощью следующих
реагентов:
+X - HСl, Y - AgNO3;
X - MgCl2, Y - Ba(NO3)2;
X - KCl, Y - NaNO3;
X - Cl2, Y - HNO3.
Превращения
 можно
осуществить с помощью следующих
реагентов:
можно
осуществить с помощью следующих
реагентов:
X - K2SO4, Y - HNO3, Z - H2CO3;
X - BaSO4, Y - HNO3, Z - CaCO3;
X - Na2SO4, Y - KNO3, Z - H2CO3;
+X - H2SO4, Y - Ba(NO3)2, Z - Na2CO3.
Превращения
![]()
можно осуществить с помощью следующих реагентов (процессов):
X - электролиз раствора, Y - KOH, Z - BaSO4;
+X - электролиз расплава, Y - H2O, Z - H2SO4;
X - C, Y - H2O, Z - K2SO4;
X - C, Y - KOH, Z - CaSO4.
Масса гидроксида кальция, которую следует прибавить к 162 г 25 %-ного раствора гидрокарбоната кальция для получения средней соли:
3,7 г;
+18,5 г;
1,0 г;
10,0 г.
При растворении в воде объемом 120 мл оксида фосфора (V) в количестве 0,2 моль получился раствор ортофосфорной кислоты с массовой долей
0,26;
+0,24;
0,22;
0,20.
Смесь оксидов меди (II) и железа (III) массой 95,5 г восстановили водородом. При действии на продукты избытка хлороводородной кислоты выделилось 4,48 л водорода (н.у.). Масса меди, образовавшейся при восстановлении:
+45 г;
32 г;
64 г;
30 г.
При пропускании электрического тока через воду образовалось 3,36 л кислорода (н.у.). Количество воды, подвергшейся разложению, составляет
0,15 моль;
13,3 моль;
+1 моль;
0,3 моль.
При полном восстановлении оксида меди (II) массой 79,5 г водородом образовалась металлическая медь массой
32,75 г;
63,5 г;
79,5 г;
+159,0 г.
Образец стали массой 5 г при сжигании в токе кислорода дал углекислый газ массой 0,1 г. Массовая доля углерода в стали составляет
0,55 %;
+2,0 %;
1,1 %
1,0 % .
Объем оксида углерода (IY) (н.у.), необходимый для получения Ca(HCO3)2 из 7,4 г Ca(OH)2, составляет
+2,24 л;
3,36 л;
4,48 л;
5,6 л .
При взаимодействии кремния с водным раствором NaOH выделилось 3,36 л H2 (н.у.). В реакции использовался технический кремний, содержащий 10% примесей. Его масса, потребовавшаяся для проведения реакции, равна
2,3 г;
1,3 г;
+3,0 г;
1,0 г.
В алюмотермическом процессе из оксида железа (III) массой 32 г образовалось железо массой 20 г. Практический выход железа от теоретического составил
+90,2%;
89,3%;
75,8%;
70,4%.
При восстановлении железа из оксида железа (III) алюминием образовалось железо массой 224 г. При этом количество вещества алюминия, вступившего в реакцию, составило
4 моль;
+2 моль;
6 моль;
12 моль.
Количество вещества и масса гидроксида натрия, необходимые для нейтрализации 14,6%-ного раствора хлороводородной кислоты массой 300 г, равны соответственно
+1,2 моль, 40 г;
1,5 моль, 60 г;
1,2 моль, 48 г;
1,5 моль, 48 г.
В эвдиометре взорвали смесь, состоящую из 4 мл водорода и 6 мл кислорода. Газ, оставшийся после взрыва, представляет собой _____ (впишите химическую формулу газа) и имеет объем
6 мл;
4 мл;
+2 мл.
оба газа прореагировали без остатка.
В стакан с 60 г 10%-ного раствора хлороводородной кислоты насыпали 9,2 г железных опилок и оставили стоять без доступа воздуха. На следующий день обнаружили, что в стакане образовалось вещество состава O2, 2
FeCl3;
FeCl2;
+FeOHCl;
Fe(OH)2Cl.
Вещества, которые можно использовать для устранения общей жесткости воды:
+Na3PO4, Na2CO3;
известковая вода, H2SO4;
Na2CO3, SO2;
NaOH, HCl.
Временная жесткость воды обусловлена присутствием в воде
+Ca(HCO3)2, Mg(HCO3)2;
NaHCO3, KHCO3;
CaCO3, MgCO3;
Na2CO3, K2CO3.
Карбонатная жесткость проявляется в результате следующих природных процессов:
+при взаимодействии известковой почвы с почвенной и дождевой водой, насыщенной атмосферным диоксидом углерода (IV);
при взаимодействии карбонатов с природными кислотами;
при растворении гипса в воде;
при химических реакциях, происходящих в почве.
В результате превращений
 образуется
конечный продукт (X3)
состава
образуется
конечный продукт (X3)
состава
KCrO2;
K2CrO4;
K2Cr2O7;
+Cr2(SO4)3 .
Одну из двух одинаковых порций гидрокарбоната натрия NaHCO3 прокалили, а затем обе порции раздельно обработали избытком хлороводородной кислоты. В каком случае и во сколько раз объем газа, образовавшегося при действии кислоты, больше? Правильным утверждением является следующее:
в случае обработки кислотой прокаленной порции - в 2 раза;
+в случае обработки кислотой непрокаленной порции - в 2 раза;
в обоих случаях выделится одинаковый объем газа.
Подберите коэффициенты в уравнении окислительно-восстановительной реакции K2SO3 + H2SO4 + KMnO4 MnSO4 + K2SO4 + H2O. В ответе укажите в уравнении сумму коэффициентов _______. 21
Подберите коэффициенты в уравнении окислительно-восстановительной реакции Na2Cr2O7 + H2SO4 + NaBr Cr2(SO4)3 + Br2 + Na2SO4 + H2O. В ответе укажите в уравнении сумму коэффициентов _________. 29
Подберите коэффициенты в уравнении окислительно-восстановительной реакции FeCl2 + HCl + KMnO4 - FeCl3 + Cl2 + MnCl2 + KCl + H2O. В ответе укажите в уравнении сумму коэффициентов ______. 60
Уравнение окислительно-восстановительной реакции, в котором правильно подобраны коэффициенты:
+H2SO4 + H2S = 2H2O + SO2 + S;
4H2SO4 + 2H2S = 6H2O + 5SO2 + S;
2H2SO4 + 4 H2S = 6H2O + SO2 + 5S.
При полном электролизе раствора хлорида натрия с платиновыми электродами получится раствор, содержащий
PtCl2;
+NaOH;
HCl;
H2O.
В процессе электролиза водного раствора NaClO4 на электродах выделятся следующие продукты:
Na, Cl2;
H2, Cl2, O2;
+H2, O2;
H2, O2, Na.
При электролизе расплава хлорида натрия на аноде выделилось 56 л хлора. Масса образовавшегося металлического натрия равна
+115 г;
100 г;
120 г;
2 моль.
Имеется раствор смеси солей: Na2SO4 и CuSO4. При электролизе этого раствора на катоде будут выделяться следующие вещества в указанной последовательности:
+Cu, H2;
Cu, Na;
H2, Na;
Cu, O2.
Сплав алюминия и меди обработали избытком раствора гидроксида щелочного металла. При этом выделилось 5,6 л (н.у.) газа. Нерастворившийся остаток отфильтровали, промыли и растворили в азотной кислоте. Раствор выпарили досуха, остаток прокалили. Масса полученного продукта составила 1,875 г. Массовая доля (%) меди в сплаве составляет
69%;
74%;
61%;
+25%.
При взаимодействии смеси железных и медных опилок с разбавленной серной кислотой выделилось 8,96 л газа (н.у.). При обработке такого же образца концентрированной азотной кислотой образовалась соль, при термическом разложении которой выделилось 11,2 л газа (н.у.). Процентное содержание меди в сплаве составляет
46,8%;
+36,4%;
57,6%;
18,2%.
При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. Химическая формула металла ______. Ca
Растворимость хлорида натрия при 25 С составляет 36,0 г в 100 г воды. Массовая доля соли в насыщенном растворе при этой температуре равна
9,5%;
5,0% ;
+26,47% ;
36%.
Смешали 100 г 10%-ного раствора хлороводородной кислоты и 100 г 10%-ного раствора гидроксида натрия. Массовая доля хлорида натрия в образовавшемся растворе составляет
+7,31%;
16,21%;
14,62%;
10%.
Какова должна быть массовая доля хлороводорода в соляной кислоте, чтобы в ней на 10 моль воды приходился 1 моль хлороводорода?
10%;
+16,86%;
25%;
8,43%.
В воде растворили 11,2 г гидроксида калия. Объем раствора довели до 257 мл. Какова молярная концентрация раствора?
+0,78 моль/л;
4,4 моль/л;
0,5 моль/л;
0,2 моль/л.
Какую массу медного купороса CuSO4 · 5H2O и воды надо взять для приготовления 40 кг 20%-ного раствора сульфата меди (II)?
8 кг CuSO4 · 5 H2O, 32 кг H2O;
10 кг CuSO4 · 5 H2O, 30 кг H2O;
+12,5 кг CuSO4 · 5 H2O, 27,5 кг H2O.
