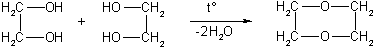Основные свойства каучука:
1) важнейшее свойство каучука – это его эластичность. Это свойство испытывать значительные упругие деформации при сравнительно небольшой действующей силе, например растягиваться, сжиматься, а затем восстанавливать прежнюю форму после прекращения действия силы;
2) ценным для практического использования свойством каучука является также непроницаемость для воды и газов.
14.
Циклоалканы
-
это предельные циклические углеводороды.
Простейшие представители этого ряда:
 Названия
циклоалканов строятся путем добавления
приставки цикло-
к
названию алкана с соответствующим
числом атомов углерода. Нумерацию в
цикле производят таким образом, чтобы
заместители получили наименьшие номера.
Названия
циклоалканов строятся путем добавления
приставки цикло-
к
названию алкана с соответствующим
числом атомов углерода. Нумерацию в
цикле производят таким образом, чтобы
заместители получили наименьшие номера.
Получение:
1. Отщепление двух атомов галогена от
дигалогеналканов:
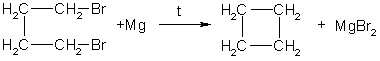
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
t°,P,Ni C6H6 + 3H2 → C6H12.
Хим. свойства: По химическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения.
1. Так, например, циклопропан и циклобутан способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном):
 Br
Br
2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора:

3. В реакцию присоединения с галогеноводородами опять же вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова:
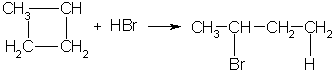
4. Реакции замещения. Обычные циклы (С6 и выше) устойчивы и вступают только в реакции радикального замещения подобно алканам:
t° С6Н12 + Вr2 → С6Н11Вr + НВr.
5. Дегидрирование циклогексана в присутствии никелевого катализатора приводит к образованию бензола:
t° Ni C6H12 → C6H6 + 3H2.
6. При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота:

15. Ароматические углеводороды – это углеводороды, молекулы которых содержат одно или несколько бензольных колец, например:
а) бензол;
б) нафталин;
в) антрацен;
2) простейшим представителем ароматических углеводородов является бензол, его формула – С6Н6;
Международное название ароматических углеводородов - арены
Источники: 1). Ароматические углеводороды содержатся в каменноугольной смоле, получаемой при коксовании каменного угля;
2) другим важным источником их получения служит нефть некоторых месторождений, например Майкопского;
3) чтобы удовлетворить огромную потребность в ароматических углеводородах, их получают также путем каталитической ароматизации ациклических углеводородов нефти.
Бензол и все соединения, которые содержат ядро бензола, названы ароматическими, поскольку первыми изученными представителями этого ряда были душистые вещества или соединения, выделенные из природных ароматных веществ.
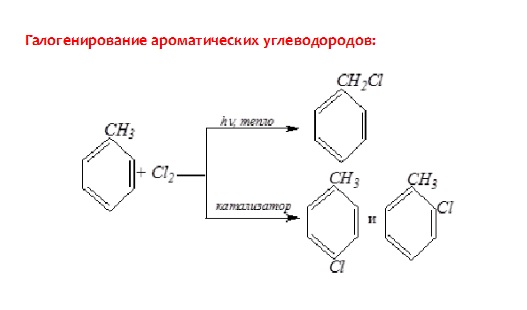
16.. Наиболее характерны для них реакции замещения атомов водорода бензольного ядра.
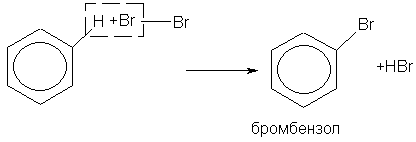
1. при взаимодействии бензола с бромом (в присутствии катализатора FеВr2) атом водорода замещается атомом брома:
При другом катализаторе можно все атомы водорода в бензоле заместить на галоген. Это происходит, например, при пропускании в бензол хлора в присутствии хлорида алюминия:
![]()
2. Если на бензол действовать смесью концентрированных азотной и серной кислот (нитрующей смесью), то атом водорода замещается нитрогруппой — NО2:
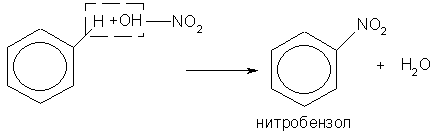
Это реакция нитрования бензола.
3. В молекуле бензола можно заместить атом водорода на алкильный радикал действием галогенопроизводных углеводородов в присутствии хлорида алюминия:

Реакции присоединения к бензолу протекают с большим трудом.
Так, в присутствии катализатора - никеля или платины - бензол гидрируется, т.е. присоединяет водород, образуя циклогексан:

Циклогексан – бесцветная летучая жидкость с запахом бензина, в воде нерастворим.
П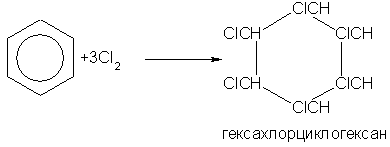 ри
ультрафиолетовом облучении бензол
присоединяет хлор:
ри
ультрафиолетовом облучении бензол
присоединяет хлор:
Бензол не присоединяет галогеноводороды и воду. Он очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор KMnO4. В обычных условиях бензольное кольцо не разрушается и при действии многих других окислителей. Однако гомологи бензола подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом:
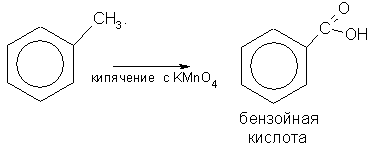
Правила ориентации:
В молекуле бензола p-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается, и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные.
Электронодонорные заместители проявляют +М и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа -ОН и аминогруппа -NH2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p-электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредотачивается в орто- и пара-положениях.
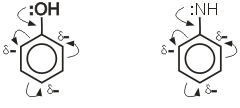
Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогруппа -NO2, сульфогруппа —SO3H, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в метаположениях:
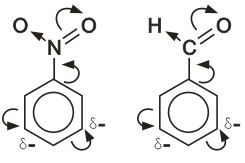
Полностью галогенированные алкильные радикалы (например. - ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца.
Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.
Заместители, обладающие +I-эффектом или +M-эффектом, способствуют электрофильному замещению в орто- и пара-положения бензольного кольца и называются заместителями (ориентантами) первого рода.
-СН3 -ОН -NH2 -CI (-F,-Вr,-I) +I +M,-I +M,-I +М,-I
Заместители, обладающие -I-эффектом или - M-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (орнентаптами) второго рода:
-S03H -ССl3 -М02 -СООН -СН=О - М -I -М,-I -М -М
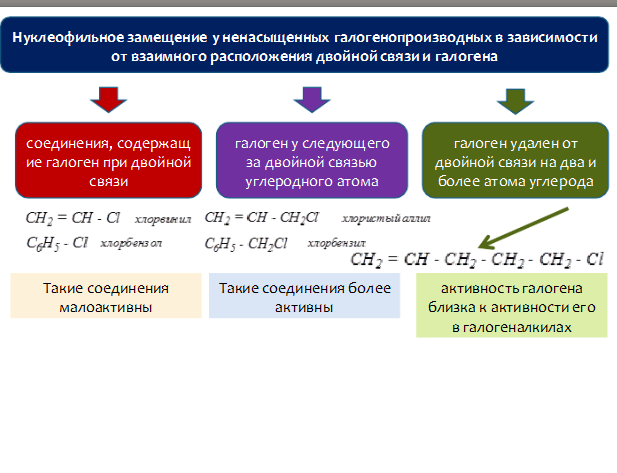
17. К галогенопроизводным углеводородов относят соединения, у которых один или несколько атомов водорода замещены на атомы галогенов. Галогенопроизводные углеводородов классифицируют в зависимости от природы углеводородного радикала (алифатические, али-циклические и ароматические), количества атомов галогена в молекуле (моно-, ди-, три- и полигалогенопроизводные), характера галогена (фторо-, хлоро-, бромо-, йодопроизводные), характера атома углерода, с которым связаны атомы галогена (первичные, вторичные и третичные галогенопроизводные).
Номенклатура.
По заместительной номенклатуре ИЮПАК названия галогенопроизводных углеводородов составляют аналогично названиям соответствующих углеводородов. Вначале цифрой указывают положение замещения (если это необходимо), затем называют галоген (если нужно — перед ним количество атомов) и прибавляют название родоначальной структуры (в алифатических галогенопроизводных это главная углеродная цепь, в али-циклических и ароматических — цикл). Простейшие галогенопроизводные называют также по радикало-функциональной номенклатуре. Тогда названия составляют из названия углеводородного радикала, связанного с галогеном, и суффикса -фторид, -хлорид, -бромид или -йодид или прибавлением слов: фтористый, хлористый, бромистый, йодистый.



18. Общая формула гомологического ряда предельных одноатомных спиртов — CnH2n+1OH. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты первичные (RCH2-OH), вторичные (R2CH-OH) и третичные (R3С-ОН). Простейшие спирты:
Первичные: СН3-ОН СН3-СН2-ОН СН3-СН2-СН2-ОН метанол этанол пропанол-1
Вторичные
Третичный

пропанол-2 буганол-2 2-метилпропанол-2
Изомерия одноатомных спиртов связана со строением углеродного скелета (например, бутанол-2 и 2-метилпропанол-2) и с положением группы ОН (пропанол-1 и пропанол-2).
Номенклатура.
Названия спиртов образуют, добавляя окончание -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Кроме того, широко распространена заместительная номенклатура, по которой название спирта производится от соответствующего углеводородного радикала с добавлением, слова "спирт", например: C2H5OH — этиловый спирт.
Получение: 1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором:
H3PO4 СН2=СН2 + Н2О → СН3—СН2—ОН.
Из этилена получается этиловый спирт, из пропена — изопропиловый. Присоединение воды идет по правилу Марковникова, поэтому из первичных спиртов по данной реакции можно получить только этиловый спирт.
2. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей:
R—Br + NaOH → R—OH + NaBr.
По этой реакции можно получать первичные, вторичные и третичные спирты.
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты, при восстановлении кетонов — вторичные:
R—CH=O + Н2 → R—CH2—OH, (1)
R—CO—R' + Н2 → R—CH(OH) —R'. (2)
Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода над никелевым катализатором.
4. Действие реактивов Гриньяра на карбонильные соединения .
5. Этанол получают при спиртовом брожении глюкозы:
С6Н12О6 → 2С2Н5ОН + 2СО2↑.
Водородная связь: Молекулы ассоциированы за счет взаимодействия положительно заряженного атома водорода гидроксильной группы одной молекулы со свободной электронной парой кислорода другой молекулы. Такой тип ассоциации носит название водородной связи. По сравнению с соответствующими углеводородами, спирты имеют высокие температуры плавления и кипения, что объясняется сильной ассоциацией молекул спирта в жидком состоянии за счет образования водородных связей.
19. Спирты являются амфотерными соединениями.
Различают два основных типа реакций спиртов с участием функциональной группы -ОН:
Реакции с разрывом связи О-Н.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами:
2С2Н5-ОН + 2K→ 2С2Н5-ОK + Н2↑, (3)
но не реагируют с щелочами. С увеличением длины углеводородного радикала скорость этой реакции замедляется.
В присутствии следов влаги соли спиртов (алкоголяты) разлагаются до исходных спиртов:
С2Н5ОK + Н2О → С2Н5ОН + KОН.
Это доказывает, что спирты — более слабые кислоты, чем вода.
2. При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления :
Н+
С2Н5ОН
+ СН3СООН
![]() СН3СООС2Н5
+ Н2О
Этилацетат
СН3СООС2Н5
+ Н2О
Этилацетат
C2H5OH + HONO2 C2H5ONO2 + Н2O Этилнитрат
Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа ОН - от кислоты. (Установлено экспериментально методом "меченых атомов" ).
3. Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
[O] [О] R-CH2-OH → R-CH=O → R-COOH.
Вторичные спирты окисляются в кетоны:
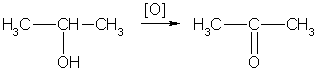
Третичные спирты могут окисляться только с разрывом С-С связей.
Реакции с разрывом связи С-О.
1) Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов:
H2SO4 ,t >150°С СН3-СН2-СН2-ОН → СН3-СН=СН2 + Н2О.
При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров:
H2SO4,t< 150°С 2CH3-CH2-OH → C2H5-O-C2H5 + H2O.
2) Спирты обратимо реагируют с галогеноводородными кислотами (здесь проявляются слабые основные свойства спиртов):
ROH + HCl RCl + Н2О
Третичные спирты реагируют быстро, вторичные и первичные - медленно.
20. Важнейшие из многоатомных спиртов - этиленгликоль и глицерин:

этиленгликоль глицерин
Это — вязкие жидкости, сладкие на вкус, хорошо растворимые в воде и плохо растворимые в органических растворителях.
Получение.
1. Гидролиз алкилгалогенидов (аналогично одноатомным спиртам):
ClCH2-CH2Cl + 2NaOH → НОСН2-СН2ОН + 2NaCl.
2. Этиленгликоль образуется при окислении этилена водным раствором перманганата калия:
СН2=СН2 + [О] + Н2О → НOСН2-СН2ОН.
3. Глицерин получают гидролизом жиров.
Химические свойства.
Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В реакциях могут участвовать одна или две гидроксильные группы. Взаимное влияние гидроксильных групп проявляется в том, что многоатомные спирты — более сильные кислоты, чем одноатомные спирты. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. По аналогии с алкоголятями соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
Качественной реакцией на многоатомные спирты, содержащие группы ОН при соседних атомах углерода, является ярко, синее окрашивание при действии свежеосажденного гидроксида меди (II). Цвет раствора обусловлен образованием комплексного гликолята меди:

Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина, известный под названием нитроглицерин (последнее название неверно с химической точки зрения, поскольку в нитросоединениях группа -NO2 непосредственно связана с атомом углерода):
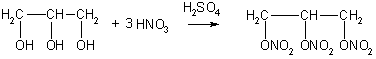
Применение: Этиленгликоль применяют для синтеза полимерных материалов и в качестве антифриза. В больших количествах он используется также для получения диоксана, важного (хотя и токсичного) лабораторного растворителя. Диоксан получают межмолекулярной дегидратацией этиленгликоля: