
- •1 Мета:
- •3 Теоретичні відомості:
- •4 Хід роботи:
- •5 Висновки:
- •Інструкція для виконання практичної роботи № 3
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання практичної роботи № 4
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання практичної роботи № 5
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання практичної роботи № 6
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання практичної роботи № 7
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання практичної роботи № 8
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
4 Хід роботи:
4.1Записати формули наступних сполук:
а) оцтовопропілового ефіру;
б) пропіоновоізопропілового ефіру.
4.2 Яку кислоту можна отримати при повному окисленні 2-метилбутаналю-1? Записати рівняння реакції.
4.3 За допомогою яких реакцій можна здійснити такі перетворення:
а) метанол - > Х - > форміат натрію;
б) оцтовий альдегід - > Y - > ацетат кальцію
Напишіть рівняння цих реакцій. Назвіть речовини Х та Y.
4.4 Складіть рівняння реакції пропіонової кислоти з:
а) гідроксидом калію; б) карбонатом калію;
в) цинком; г) гідроксидом алюмініб.
5 Висновки:
6 Контрольні питання:
6.1 Які сполуки відносять до карбонових кислот? Що лежить в основі класифікації карбонових кислот?
6.2 Як змінюються властивості водневих атомів гідроксильних групу ряді речовин: одноатомні спирти, багатоатомні спирти, феноли, карбонові кислоти?
6.3 Одноосновна карбонова кислота має такий склад: С- 26,10%, Н – 4,35%,
О – 69,55%. Використавши ці дані , знайдіть молекулярну формулу кислоти.
Література
1 Н.М.Буринська, Л.П. Величко Хімія 11 клас. Підручник для загальноосвітніх навчальних закладів. Київ ПЕРУН , 2002.
2 Потапов В.М., Татаринчик С.Н. Органическая химия, учебник для учащихся химических и химико-технологических специальностей техникумов. -Москва: «Химия», 1989.
Інструкція для виконання практичної роботи № 8
Тема: Аміни, їх структурні формули і властивості.
1 Мета:
1.1Закріпити теоретичні знання з теми « аміни».
2 Матеріально-технічне та навчально-методичне забезпечення:
2.1 Інструкція для виконання практичної роботи № 8.
2.2 Роздатковий матеріал.
3 Теоретичні відомості:
Амі́ни — нітрогенвмісні органічні хімічні сполуки, похідні амоніаку (NH3), в якому атоми гідрогену заміщені однією чи багатьма групами інших атомів — вуглеводневими радикалами.
Якщо амін створений заміщенням одного атома гідрогену в NH3, він називається первинним аміном (формула RNH2), якщо двох — вторинним аміном (R2NH), а якщо трьох — третинним аміном (R3N). Четвертинні аміни мають чотири замісники при атомі нітрогену, внаслідок чого атом нітрогену в цих амінах має електричний заряд +1.
Залежно від природи радикалів аміни називаються: аліфатичними, ароматичними та гетероциклічними. Нижчі аліфатичні аміни — гази, вищі — рідини й тверді речовини. Найважливішим ароматичним аміном є анілін.
Аміни проявляють основні властивості через наявність у атома нітрогену неподіленої електронної пари. Однією з важливих реакцій аліфатичних амінів є взаємодія їх з HNO2: первинні аміни при цьому утворюють спирти, вторинні — нітрозаміни, третинні не реагують. Ароматичні первинні аміни з HNO2 утворюють діазосполуки.
Аміни широко використовуються в анілофарбувальній та хімічно-фармацевтичній промисловості, наприклад, як складники реагентів при флотації та масляній агломерації (грануляції, флокуляції) вугілля.
Аміни з коротким радикалом добре розчинюються у воді, зі збільшенням довжини вуглеводневого радикалу розчинність амінів зменшується.
Отримання
1 отримання за реакцією Гофмана
2NН3 + СН3Br → СН3NН2 + NН4Br;
СН3NН2 + CН3Br + NН3 → (СН3)2NН + NН4Br;
(СН3)2NН + CН3Br + NН3 → (СН3)3N + NН4Br
отримання ароматичних амінів за реакцією Зініна
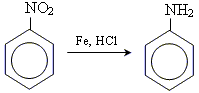
Хімічні властивості
1 Основні властивості амінів
СН3NН2 + H2O = [СН3NН3]OH = [СН3NН3] + + OH-;
СН3NН2 + HCl = [СН3NН3]Cl
Аміни є більш слабкими основами, ніж аміак. Зі збільшенням величини вуглеводневого радикалу основні властивості послаблюються. Ароматичні аміни є більш слабкими основами ніж аліфатичні аміни.
2 Горіння амінів
4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
