
- •Катализаторами называются вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
- •31.Химическое равновесие в гомогенных и гетерогенных системах, константа равновесия для гомогенных и гетерогенных обратимых реакций. Примеры. Химическое равновесие в гетерогенных системах
- •5.2.1. Константа равновесия гетерогенной реакции
- •Химическое равновесие в гомогенных системах
- •5.1.1. Константа химического равновесия
- •5.1.2. Влияние температуры на константу равновесия
- •32.Принцип Ле Шателье . Влияние температуры, давления, концентрации реагентов на положение равновесия обратимых реакции. Примеры.
- •33.Общие представления о растворах. Химическая и физическая теории растворов. Способы выражения концентрации растворов, примеры.
- •Способы выражения концентрации растворов
- •Второй закон Рауля
- •]Понижение температуры кристаллизации растворов
- •Повышение температуры кипения растворов
- •Вывод значения ионного произведения воды
Способы выражения концентрации растворов
Концентрацию веществ в растворах можно выразить разными способами.
Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w(B)= m(B) / m

Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение m(Na2SO4) = w(Na2SO4) / 100 = (5 · 300) / 100 = 15 г
где w(Na2SO4)) – массовая доля в %, m - масса раствора в г m(H2O) = 300 г - 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4)и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Пример Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение M(K2CrO4) = C(K2CrO4) · V · M(K2CrO4) = 0,1 моль/л · 1,2 л · 194 г/моль » 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд Пример Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Величины нормальности обозначают буквой "Н". Например, децинормальный раствор серной кислоты обозначают "0,1 Н раствор H2SO4". Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение Для вычисления молярности и нормальности надо знать число граммов H2SO4в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 · 1000 / 61,92 = 1130,49 г H2SO4 Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
34. давление пара растворов. 1 закон Рауля.
Давление насыщенного пара растворов. Закон Рауля
Представим, что в равновесную систему жидкость А – пар введено некоторое вещество В. При образовании раствора мольная доля растворителя XА становится меньше единицы; равновесие в соответствии с принципом Ле Шателье – Брауна смещается в сторону конденсации вещества А, т.е. в сторону уменьшения давления насыщенного пара РА. Очевидно, что, чем меньше мольная доля компонента А в растворе, тем меньше парциальное давление его насыщенных паров над раствором. Для некоторых растворов выполняется следующая закономерность, называемая первым законом Рауля:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
![]() (1)
(1)
Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:
![]() (2)
(2)
Относительное понижение парциального давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
Первый закон Рауля нетрудно вывести, используя понятие химического потенциала компонента, если считать пар над раствором идеальным газом. Условием гетерогенного равновесия является равенство химических потенциалов компонентов системы во всех фазах. Химический потенциал растворителя в растворе μА(р) связан с мольной долей растворителя в растворе XА уравнением (3):
![]() (3)
(3)
Химический потенциал растворителя в паре μА(п) можно выразить через парциальное давление пара растворителя РА:
![]() (4)
(4)
Химический потенциал чистого жидкого растворителя μ*А равен химическому потенциалу равновесного пара:
![]() (5)
(5)
В состоянии равновесия μА(п) = μА(р). Комбинируя выражения (3-5), легко получить:
![]() (6)
(6)
Принимая, что μ*А = μ°А(р), получаем следующее уравнение:
![]() (7)
(7)
Отсюда легко получить выражение для первого закона Рауля:
![]() =>
=> ![]() =>
=> ![]() (8)
(8)
Растворы, для которых выполняется первый закон Рауля, называют идеальными растворами. Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т.п.) и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области бесконечно малых концентраций.
Если компоненты бинарного раствора летучи, то пар над раствором будет содержать оба компонента (относительное содержание компонентов в парах будет, как правило, отличаться от содержания их в растворе: пар относительно богаче компонентом, температура кипения которого ниже – см. следующий параграф). Рассмотрим идеальный бинарный раствор, состоящий из компонентов А и В, неограниченно растворимых друг в друге. Общее давление пара, согласно первому закону Рауля, равно
![]() (9)
(9)
Таким образом, для идеальных бинарных растворов зависимость общего и парциального давления насыщенного пара от состава раствора, выраженного в мольных долях компонента В, является линейной при любых концентрациях (рисунок 1). К таким системам относятся, например, системы бензол – толуол, гексан – гептан, смеси других изомерных углеводородов. Для реальных растворов данные зависимости являются криволинейными (рисунок 2).
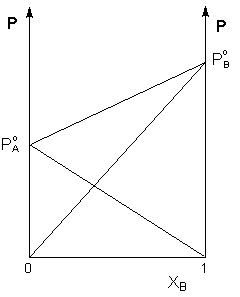
Рис. 1. Зависимость парциальных и общего давлений пара идеального раствора от концентрации.
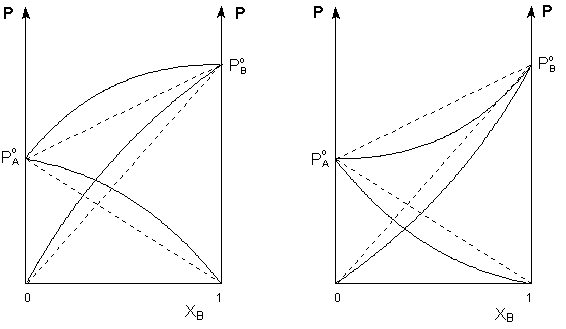
Рис. 2. Зависимость парциальных и общего давлений пара идеальных (штриховая линия) и реальных (сплошная линия) бинарных растворов от состава при положительных (слева) и отрицательных (справа) отклонениях от закона Рауля.
Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения).
Образование реальных растворов сопровождается тепловым и объёмным (т.н. контракция) эффектами. Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходным объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0) ); объём раствора в этом случае будет меньше, чем сумма исходным объёмов компонентов (ΔV < 0).
35. температуры кипения и кристализации расворов. 2 закон Рауля
