
- •Катализаторами называются вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
- •31.Химическое равновесие в гомогенных и гетерогенных системах, константа равновесия для гомогенных и гетерогенных обратимых реакций. Примеры. Химическое равновесие в гетерогенных системах
- •5.2.1. Константа равновесия гетерогенной реакции
- •Химическое равновесие в гомогенных системах
- •5.1.1. Константа химического равновесия
- •5.1.2. Влияние температуры на константу равновесия
- •32.Принцип Ле Шателье . Влияние температуры, давления, концентрации реагентов на положение равновесия обратимых реакции. Примеры.
- •33.Общие представления о растворах. Химическая и физическая теории растворов. Способы выражения концентрации растворов, примеры.
- •Способы выражения концентрации растворов
- •Второй закон Рауля
- •]Понижение температуры кристаллизации растворов
- •Повышение температуры кипения растворов
- •Вывод значения ионного произведения воды
30. катализ, причина ускоренного действия катализатора. Гомогенный и гетерогенный катализ, примеры.
Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами).
Каталитические реакции весьма распространены в химии и некоторые из них можно провести даже в домашних условиях. Например, 3%-ный раствор перекиси водорода (именно такой продают в аптеках) вполне устойчив в отсутствие примесей. Но при добавлении очень небольшого количества (нескольких крупинок) твердого диоксида марганца MnO2 начинается реакция разложения Н2О2 с выделением газообразного кислорода:
![]()
Здесь MnO2 - катализатор реакции. Можно заметить, что в химическом уравнении катализатор не присутствует среди реагентов или продуктов, его не нужно учитывать и при уравнивании реакции. Поэтому обычно катализатор в уравнении указывают над стрелкой. Если у вас под рукой нет диоксида марганца, его вполне можно заменить двумя-тремя крупинками марганцовки из домашней аптечки: KMnO4 при действии Н2О2 быстро превратится в MnO2 (полезно написать уравнение этой реакции). Дальше полученный катализатор, вне зависимости от его количества, будет работать до тех пор, пока не закончится весь реагент - перекись водорода. Этот опыт можно проводить дома только с разбавленным (аптечным) раствором перекиси водорода. С концентрированным раствором реакция идет очень бурно. Диоксид марганца - не единственный катализатор реакции разложения перекиси водорода. Биологические катализаторы (ферменты), содержащиеся в крови, действуют так же. Именно поэтому слабый раствор перекиси водорода, нанесенный на царапину, начинает пузыриться (выделяющийся при этом кислород дезинфицирует ранку).
Удивительным в явлении катализа является то обстоятельство, что катализаторы, активно участвуя в реакции, сами в итоге не изменяются. Другими словами, катализаторы не расходуются в ходе химической реакции. Поскольку катализатор способен многократно участвовать в промежуточных химических взаимодействиях с реагентами, его часто берут в небольшом количестве - значительно меньшем по сравнению с реагентами.
В качестве катализаторов часто выступают обычные кислоты, основания, оксиды металлов или сами металлы. Но бывают и сложные катализаторы, поиск и приготовление которых требуют большого труда.
Различают положительный катализ (ускорение реакций) и отрицательный катализ (замедление реакций). Обычно термин «катализ» относят именно к положительному катализу, а отрицательный называют ингибированием. Соответственно «отрицательные катализаторы» называются ингибиторами. Например, в качестве ингибитора реакции разложения перекиси водорода используют очень небольшую (1 : 10000) добавку пирофосфата натрия Na4P2O7. Его роль заключается в связывании следов примесей, которые являются хорошими катализаторами реакции разложения перекиси водорода - соединений Cu, Mn и некоторых других тяжелых металлов.
Катализаторами называются вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
Еще одно важное свойство катализаторов заключается в способности повышать избирательность протекания реакций. Если какие-то реагенты могут реагировать между собой по разным направлениям (то есть давать несколько различных продуктов), то с участием катализаторов во многих случаях образуется только какой-то один продукт реакции. Избирательное протекание реакции называется селективностью. Таким образом, главные полезные свойства катализаторов заключаются в повышении скорости и селективности химических реакций.
В качестве примера рассмотрим реакцию разложения этилового спирта СН3СН2ОН (этанола). Без катализатора эта реакция идет с трудом (нужна высокая температура) и не селективно. Один путь реакции приводит к образованию этилена Н2С=СН2 и воды Н2О, другой - уксусного альдегида СН3СНО и водорода Н2:

При пропускании паров этанола через накаленную до 700 оС стеклянную трубку обе реакции идут параллельно. Примерно 20% этанола превращается в этилен и воду, а 80% - в уксусный альдегид и водород. Такие жесткие условия характерны для реакций с высокой энергией активации Еа. В свою очередь, Еа тем выше, чем более неустойчивыми являются промежуточные соединения, образующиеся на пути от реагентов к продуктам.
Поверхность катализатора неоднородна. На ней имеются так называемые активные центры, на которых главным образом и протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах, в результате чего увеличивается концентрация их на поверхности катализатора. А это отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул. Под действием катализатора у адсорбированных молекул ослабляются связи между атомами и они становятся более реакционноспособными. И в этом случае реакция ускоряется благодаря снижению энергии активации (в том числе за счет образования поверхностных промежуточных соединений).
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами. В качестве примера можно привести соединения мышьяка, ртути, свинца, цианистые соединения, к которым особенно чувствительны платиновые катализаторы. В производственных условиях реагирующие вещества подвергают очистке от каталитических ядов, а уже отравленные катализаторы регенерируют.
Гомогенный катализ, ускорение химической реакции в присутствии катализатора, который находится в одной фазе с исходными реагентами (субстратами) в газовой фазе или растворе. При гомогенном катализе, как и при гетерогенном, катализатор в реакции не расходуется, однако является ее необходимым участником; без катализатора реакция протекает гораздо медленнее или не идет вовсе.
Механизм гомогенно-каталитических реакций. Можно выделить сравнительно небольшую группу процессов, в которых участие катализатора не связано с образованием определенного химического соединения с субстратом. К таким процессам относится, например, катализ парамагнитными частицами синглет-триплетного превращения карбенов (изменяется электронный спин молекулы) или орто-, пара-превращение Н2 (изменяется ядерный спин). Формально к гомогенному катализу можно отнести газофазные реакции рекомбинации атомов и простейших радикалов в присутствии химически инертных частиц, которые, участвуя в тройном соударении, обеспечивают отвод энергии, выделяющейся при образовании химической связи. Однако в огромном большинстве случаев механизм гомогенного, как и гетерогенного катализа, включает более или менее сложное химическое превращение катализатора в реакциях.
Рассмотрим в качестве примера гомогенный катализ окислительно-восстановительной некомплементарной реакции, такой реакции, в которой число электронов. отдаваемых одной частицей восстановителя и принимаемых одной частицей окислителя, не совпадает. В реакции 2Се4+ + Tl+ -> 2Се3 + + Tl3+ последовательное одноэлектронноеокисление Т1+
![]()
затруднено из-за высокого окислительно-восстановительного потенциала пары Тl2+/Тl+ (для пары Тl3+/Тl2+ этот потенциал значительно ниже). В присутствии ионов марганца реакция протекает по многостадийному механизму:
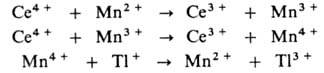
Ионы марганца переводят одноэлектронный перенос в реакциях Мn2+ и Мn3 с Се4 + в двухэлектронный - в реакции Мn4+ с Тl+ (все реакции с участием ионов Мn комплементарны). Протекание всех стадий облегчается из-за того, что для пар Мn4+ Mn3+ и Mn3+ /Mn2+ окислительно-восстановительные потенциалы близки и расположены между значениями этих потенциалов для пар Се4+ /Се3+ и Тl3+ /Тl+ .
В радикально-цепных процессах в присутствии некоторых веществ может ускоряться образование радикалов в реакциях зарождения или разветвления цепи. Так, при окислении органического вещества RH в присутствии ионов Со в небольшой концентрации ускоряется разветвление цепи, а при высокой концентрации этих же ионов - также и развитие цепи. Каталитический механизм распада гидропероксида включает следующие стадии:
![]()
ГЕТЕРОГЕННЫЙ КАТАЛИЗ (контактный катализ), изменение скорости хим. реакции при воздействии катализаторов, образующих самостоят. фазу и отделенных от реагирующих веществ границей раздела. наиб. распространен случай, когда твердый кат. (контакт) ускоряет реакцию между газообразными реагентами или реакцию в растворе. Каталитич. реакция протекает обычно на пов-сти твердого кат. и обусловлена активацией молекул реагентов при взаимод. с пов-стью. Поэтому для осуществления гетерогенный катализ необходима адсорбция компонентов реакц. смеси из объемной фазы на пов-сти катализатора.
В техн. гетерогенный катализ свойство катализатора ускорять реакцию обычно определяют как выход продукта в единицу времени, отнесенный к единице объема или массы катализатора. В теоретич. исследованиях скорость v гетерогенно-каталитич. р-ций относят к единице пов-сти катализатора и наз. удельной каталитич. активностью; ее размерность - моль х х с-1 м-2(см. Активностькатализатора). Если все активные центры пов-сти однородны и равнодоступны молекулам реагирующих веществ, v пропорциональна пов-сти S:
![]()
где f- ф-ция концентраций сA, сB, ... реагентов и продуктов реакции в объемной фазе, k-константа скорости, отнесенная к единице пов-сти катализатора. Соотношение (1) м. б. неприменимо, если гетерогенно-каталитич. реакция осложнена диффузией реагирующих молекул, в случае неоднородной пов-сти и др. (подробнее см.Каталитических реакций кинетика).
Развитие эксперим. техники сделало возможным в ряде случаев относить скорость гетерогенно-каталитич. реакции к единичному активному центру пов-сти. Применение сверхвысокого вакуума (~10-8Па) позволило получить атомарно чистые пов-сти металлов (свободные от адсорбиров. частиц), на которых все атомы (их число Nc ~ 1019 м-2) являются активными центрами. Число молекул, подвергающихся превращениям на одном активном центре в секунду, наз. числом оборотов реакции tn. Скорость реакции связана с tn соотношением:
![]()
Для многих реакций tn составляет от 10-2 до 102 с -1 однако возможны как существенно меньшие, так и большие значения. Напр., в случае окисления NH3 на пром. катализаторе tn достигает 5*104 с-1, а для той же реакции намонокристалле Pt при низком давлении -10-6 с-1.
Число активных центров на катализаторах-оксидах металлов оценить труднее. Спектральные методы (оптическая и ИК-спектроскопия, ЭПР и др.) позволяют следить за изменением структуры пов-сти этих веществ в условияхгетерогенный катализ и соотносить эти изменения с изменениями скорости реакции; отсюда можно оценить поверхностную концентрацию активных центров. Оказалось, что для большинства оксидных кат. число активных центров меньше, чем для металлов, и составляет 1014-1018 м-2. <p.Константы скорости каталитич. реакции изменяются с температурой Г в соответствии с ур-нием Аррениуса: k = = k0ехр( — E/RT), где k0-предэкспоненц. множитель,Е-энергия активации, R- газовая постоянная. Величина k0 м. б. вычислена методами <i.активированного комплекса теории.</i.однако сопоставление расчетных значений с экспериментальными возможно лишь при условии, если точно известно число активных центров на пов-сти реального катализатора. Значения Е определяются из эксперим. зависимости k отТ, обычно они составляют 10-150 кДж/моль.</p.
Катализаторы гетерогенный катализ обладают высокой селективностью, т. е. относит. способностью ускорять одну из неск. одновременно протекающих реакций. Часто на одном и том же катализаторе могут протекать одновременно неск. последовательных и параллельных реакций. Напр., каталитич. окисление углеводородов может протекать последовательно-сначала до получения ценных кислородсодержащих соед., затем до полного их окисления с образованием СО2 и Н2О. Наряду с этим может протекать и параллельное окисление исходного вещества непосредственно до СО2 и Н2О, без выхода ценных промежут. продуктов мягкого окисления в газовую фазу. В простейшем случае мягкого окисления углеводорода СnНm+2, до продукта СnНmО (напр., при получении этиленоксидаС2Н2О из этилена С2Н4) процесс м. б. описан схематически след, образом:
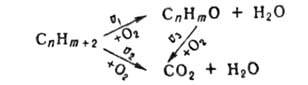
Селективность s катализатора определяется как отношение скорости накопления целевого продукта к сумме скоростей всех реакций, протекающих с участием исходных веществ.
