
- •Вопрос1
- •Вопрос 2
- •Вопрос 3
- •Вопрос4
- •Вопрос 5
- •Период и группа
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 40
- •Вопрос 42
- •Вопрос 43
- •Вопрос 46
- •Вопрос 47
- •Вопрос48
- •Вопрос 49
- •Вопрос 50
- •Вопрос 52
- •Вопрос 53
- •Вопрос 54
- •Вопрос 55
- •Вопрос 56
- •Вопрос 57
- •Вопрос 58
Вопрос 27
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇌ 2NH3.
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇌ 2NO2
складывается из элементарных реакций
N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4.
Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Закон действующих масс в химической термодинамике
В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению:
![]()
где
ai — активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов);
νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);
Ka — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.
На практике в расчётах, не требующих особой точности, значения активности обычно заменяются на соответствующие значения концентраций (для реакций в растворах) либо парциальных давлений (для реакций между газами). Константу равновесия при этом обозначают Kc или Kp соответственно. Впервые закон действующих масс был выведен из кинетических представлений Гульдбергом и Вааге, а термодинамический вывод его дан Вант-Гоффом в 1885 году[3].
Пример: для стандартной реакции
![]()
константа химического равновесия определяется по формуле
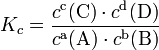
Вопрос 28
Принцип Ле Шателье – Брауна, называемый также принципом смещения «Если на систему, находящуюся в равновесии, производится внешнее воздействие, то равновесие смещается в том направлении, при котором система как бы вновь восстанавливает своё прежнее состояние».
Значение принципа заключается в том, что он позволяет делать определённые предсказания в отношении эволюции системы, находящейся под внешним воздействием. В химии он используется для увеличения выхода реакции, а в фармакологии – для уточнения условий баланса биологической системы при связи лигандов с рецепторами .В экономике принцип позволяет объяснить равновесие цен в эффективных экономических системах.
Классическое выражение принципа в химии имеет вид:
«Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, объём, давление, концентрация), то равновесие смещается таким образом, чтобы уменьшить изменение». Влияние концентрации
Концентрация влияет на состояние равновесия следующим образом:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
В качестве иллюстрации рассмотрим реакцию угарного газа с водородом, с образованием метилового спирта: CO + 2 H2 ↔ CH3OH
В данной реакции выход метилового спирта будет больше при увеличении концентрации CO. Эффективность реакции также возрастёт при непрерывном удалении продуктов реакции.
Влияние температуры
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому. Для примера рассмотрим реакцию взаимодействия азота с водородом с образованием аммиака: N2 + 3 H2 ↔ 2 NH3 + Q, где Q = 92 кДж на 1 моль.
Прямая реакция — экзотермическая, идущая с выделением тепла а обратная реакция — эндотермическая, требующая поглощения тепла.
Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении исходных веществ реакции; При понижении температуры химическое равновесие смещается в направлении продуктов реакции. Следовательно, в приведённой реакции по мере выделения тепла растёт температура, что снижает выход аммиака. Влияние давления
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам реакции, на положение равновесия влияет давление в системе. Влияние давления на положение равновесия подчиняется следующим правилам: При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов реакции) с меньшим объемом; При понижении давления равновесие сдвигается в направлении образования веществ с большим объемом; При равенстве объёмов исходных веществ и продуктов реакции давление не влияет на равновесие реакции. Рассмотрим снова реакцию азота с водородом: N2 + 3 H2 ↔ 2 NH3
Считая, что каждый моль газа при стандартных условиях занимает один и тот же объём, в левой части равенства имеем 4 объёма, а в правой части – два объёма. Таким образом, при переходе от исходных веществ к продукту реакции (аммиаку) объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400°С:
давление, МПа |
0,1 |
10 |
20 |
30 |
60 |
100 |
объемная доля NH3, % |
0,4 |
26 |
36 |
46 |
66 |
80 |
