
- •Б. 11. 1.Уравнения max работы Гиббса-Гельмгольца, их вывод и анализ.
- •Б.11.2.Активности компонентов раствора. 3 шкалы активности.
- •Б.12.1.Статистический хар-р 2 закона термодинамики. Ур. Больцмана, его вывод и анализ.
- •Б.12.2.Осмос. Вывод уравнения для расчета осмотического давления.
- •Б. 13.1.Термодин. Потенциалы идеальных и реал. Газов. Летучесть реал. Газа и ее расчет.
- •Б.13.2. Гетерог. Равновесия. Составл. В-ва системы, комп-ты, фазы, степ. Свободы. Правило фаз.
- •Б.14.1.Фаз. Переходы I рода для индив. В-в. Урав. Клапейрона-Клаузиуса. Фаз. Переходы II рода.
- •Б.14.2. Диаграммы состояния воды, серы, бензофенона.
- •Диаграмма состояния серы
- •Б. 15.1. Уравн. Для характер. Функций многокомпон. Систем, . Урав. Гиббса-Дюгема.
- •Б.15.2. Условия хим. Равновесия. Здм (вывод, анализ). Разл. Формы выражения к равн.
- •Б.16.1.Давление нас. Пара бинарных р-ров. Закон Рауля. Ид. Растворы. Предельно разбавл. Р-ры.
- •Б.16.2. Влияние т на хим. Равновесие. Уравн. Изохоры и изобары –ц-, их вывод, анализ, интегр-е.
- •Б. 17.1.Отклонения от законов идеальных растворов, причины отклонений.
- •Диаграмма сост. Системы, образ. Хим. Соединение, плавящееся инконгруентно (с разложением).
- •Б.18.1.Огр. Взаим. Р-ть жидкостей. Р-ть газов в жидкостях. З. Генри, Дальтона, Сеченова. Влияние t0.
- •Б.18.2.Трехкомпонентные системы. Способы изобр. Состава. Диаграмма с тройной эвтектикой.
- •Б.19.1.Растворимость тв. В-в в жидкостях. Уравнен. Р-ти в ид. И пред. Разб. Р-рах. Откл. От ид. Р-ти.
- •Б.19.2. Диаграмма состояния 2хкомпонентной системы с неогр. Взаимной р-тью компонентов.
Б.12.2.Осмос. Вывод уравнения для расчета осмотического давления.
Равновесие осущ-ся при рав-ве Т и Р во всех частях всех фаз в системе и при постоянстве состава во всех участках одной фазы. Если есть разности компонентов м/у участками одной фазы или м/у разными фазами, эти компон. диффундируют в направлении падения своего до тех пор, пока не будет достигнут одинак. состав во всех участках внутри каждой фазы и равновесное распределение компонентов м/у фазами. Необх. усл. достижения такого равновесия явл. возм-ть своб. перехода всех компонентов из 1 участка каждой фазы в др. участок и из 1 фазы в др. Иная картина, когда отд. части системы разделены перегородками, которые непроницаемы для одних компонентов и проницаемы для других (н-р, кожа, пергамент). Сосуд 1 содерж. водный р-р какого-либо в-ва; закрыт внизу полупрониц.
h
2 |
перегородкой. Сос.1 помещен в сос.2 с водой. Вода будет проходить из 2 в 1. Осмос – самопроизв. переход воды (или р-ля) ч/з полупроницаемую перегородку в р-р. Осмот. давление ()- сила (на ед. S), заставляющая р-ль переходить ч/з полупрониц. перегородку в р-р (наход. при том же внеш. Р, что и р-ль), Из-за осмоса уровень р-ра в сос. 1 повышается, создавая дополн. Р, |
j
препятствует осмосу. При нек. h
столба жидк. в сос. 1 доп. Р достигает
такой вел-ны, при j
осмос прекращается (устанавлив. равновесие
м/у р-ром данной конц. и чистым р-лем,
разделёнными полупрониц. перегородкой).
Равновесию м/у р-ром данной конц. и чистым
р-лем соотв-ет определ. гидростатическое
Р в сосуде с р-ром. Оно =
и отл. от него только знаком. Т.к. измеряемой
вел-ной явл. гидростат. Р, то
можно
определить как дополн. Р, j
необх. приложить к р-ру, чтобы предотвратить
поступление в него (или удаление из
него) р-ля ч/з полупрониц. перегородку.
Впервые
измерил Пфефер. Вант-Гофф показал, что
в разб. р-рах зав-ть
от конц. совпадает по форме с з.
Бойля-Мариотта для ид. газов.
Для
р-ров с с
0,3М V
= 22,6 латм/моль
(для ид. газов PV
= 22,4 ; V
– объем, закл. 1 моль раств. в-ва); при ↑
конц. ↑ V
.
Т. Закономерности
разб. р-ров охватываются урав.
Вант-Гоффа
:
= cRT
(с
– моляр. конц.; с
= (n2/V)
= g2/(M2V))
Т.о.,
разб. р-ров численно равно тому Р, j
производило бы то же число молекул
раств. в-ва, если бы оно в виде ид. газа
занимало при данной Т объем, равный
объему р-ра. Р-ль и р-р, разделенные
полупрониц. перегородкой и нах-ся в
равновесии, представляют 2 фазы, один
из компонентов которых, свободно
проходящий из одной фазы в другую, должен
иметь в обеих фазах равные .
В
чистом р-ле его 1о
= const
при Т, Р1
= const
(Р1
– внешнее). В р-ре же его значение 1
изм. с изм-ем N1
и Р2
(Р2
= Р1
+
– сумма первонач. Р и доп. гидростат. Р
в р-ре, равного ).
Это изменение можно найти, дифференцируя
1
= 1о
по N1
и Р2
, учитывая, что d1o
= 0. d1
=
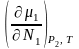 dN1
+
dN1
+
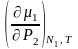 dP2
= d1o
= 0;
=
dP2
= d1o
= 0;
=
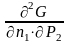 =
=
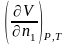 =
=
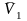 ;
(
Т.к. i
=
;
(
Т.к. i
=
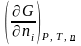 и
и
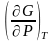 = V
);
– обозначение частной производной по
ni;
1
= 1o
+ RT
ln
a1
= RT
= V
);
– обозначение частной производной по
ni;
1
= 1o
+ RT
ln
a1
= RT
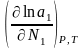 ;RT
dN1
+
dP2
= 0;
dP2
= –
;RT
dN1
+
dP2
= 0;
dP2
= –
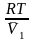 dN1
. Интегрируем, считая
const :
dN1
. Интегрируем, считая
const :
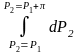 = –
= –
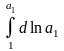 (пределы
интегрирования : нижний – чистый р-ль,
верхний – р-р); Р1
+
– Р1
= –
ln
a1;
a1
= P1
/
P1o
; P1
и P1o
– давл. нас. пара р-ля над р-ром и над
чистым р-лем.
= –
ln
(пределы
интегрирования : нижний – чистый р-ль,
верхний – р-р); Р1
+
– Р1
= –
ln
a1;
a1
= P1
/
P1o
; P1
и P1o
– давл. нас. пара р-ля над р-ром и над
чистым р-лем.
= –
ln
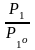 (1)
(1)
Для ид. р-ров N1 = P1 / P1o (урав. Рауля): ид = – ln N1 = – ln (1 – N) (2)
Для
разб. р-ров
(N
1): – ln
(1
– N)
= N
+
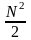 + …
N
; N
=
+ …
N
; N
=
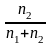
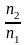
разб
=
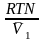 =
=
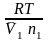
n2
n2
Если n2 n1 , то n1 = V (объему р-ра); n2 /V = c2 – моляльность. Получаем для разб. р-ров ур. Вант-Гоффа :
разб
= с2RT
=
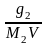 RT
(3)
RT
(3)
Уравнение справедливо только для разб. р-ров, подчин. з. Рауля. При ↑ конц., даже если р-р идеален, урав. Вант-Гоффа неприменимо и заменяется урав. (2); в общем случае неид. р-ров справедливо лишь урав. (1). Р реал. газов в обычных условиях меньше Р ид. газов из-за влияния кохезионных сил (притяжения м/у молек. газа). реал. р-ров знач. > ид. р-ра. явл. тем добав. Р, j увел. р-ля в р-ре и этим компенсирует уменьш. р-ля, вызванное растворением 2го компонента. Это создает возм-ть равновесия р-ра с чистым р-лем при наличии полупрониц. перегородки.

 1
1
