
- •Б. 11. 1.Уравнения max работы Гиббса-Гельмгольца, их вывод и анализ.
- •Б.11.2.Активности компонентов раствора. 3 шкалы активности.
- •Б.12.1.Статистический хар-р 2 закона термодинамики. Ур. Больцмана, его вывод и анализ.
- •Б.12.2.Осмос. Вывод уравнения для расчета осмотического давления.
- •Б. 13.1.Термодин. Потенциалы идеальных и реал. Газов. Летучесть реал. Газа и ее расчет.
- •Б.13.2. Гетерог. Равновесия. Составл. В-ва системы, комп-ты, фазы, степ. Свободы. Правило фаз.
- •Б.14.1.Фаз. Переходы I рода для индив. В-в. Урав. Клапейрона-Клаузиуса. Фаз. Переходы II рода.
- •Б.14.2. Диаграммы состояния воды, серы, бензофенона.
- •Диаграмма состояния серы
- •Б. 15.1. Уравн. Для характер. Функций многокомпон. Систем, . Урав. Гиббса-Дюгема.
- •Б.15.2. Условия хим. Равновесия. Здм (вывод, анализ). Разл. Формы выражения к равн.
- •Б.16.1.Давление нас. Пара бинарных р-ров. Закон Рауля. Ид. Растворы. Предельно разбавл. Р-ры.
- •Б.16.2. Влияние т на хим. Равновесие. Уравн. Изохоры и изобары –ц-, их вывод, анализ, интегр-е.
- •Б. 17.1.Отклонения от законов идеальных растворов, причины отклонений.
- •Диаграмма сост. Системы, образ. Хим. Соединение, плавящееся инконгруентно (с разложением).
- •Б.18.1.Огр. Взаим. Р-ть жидкостей. Р-ть газов в жидкостях. З. Генри, Дальтона, Сеченова. Влияние t0.
- •Б.18.2.Трехкомпонентные системы. Способы изобр. Состава. Диаграмма с тройной эвтектикой.
- •Б.19.1.Растворимость тв. В-в в жидкостях. Уравнен. Р-ти в ид. И пред. Разб. Р-рах. Откл. От ид. Р-ти.
- •Б.19.2. Диаграмма состояния 2хкомпонентной системы с неогр. Взаимной р-тью компонентов.
Б.19.1.Растворимость тв. В-в в жидкостях. Уравнен. Р-ти в ид. И пред. Разб. Р-рах. Откл. От ид. Р-ти.
Тв. в-во не может беспредельно растворяться в жидкостях: при достижении некоторой конц., определ. при данных Р и Т, тв. в-во перестает растворяться; устанавливается равновесие м/у р-ром и тв. в-вом. Насыщенный р-р – р-р, находящийся в равновесии с тв. в-вом, а его конц. – р-ть тв. в-ва.
Хим. потенциалы раствор. в-ва в насыщ. р-ре (нас) и в тв. фазе (т) имеют одно и то же значение :
нас = т ; 2 = 2о + RT ln a2 ; 2, нас = 2о + RT ln a2, нас ; 2, нас – т = 2о + RT ln a2, нас – т = 0
– RT ln a2, нас = 2о – т = G ; G = H + T – уравнение Гиббса-Гельмгольца
Растворение тв. в-ва в жидкости можно представить как 2 последовательно протекающих –ц- : 1) плавление тв. в-ва; 2) смешение 2х жидкостей. В случае ид. р-ров теплота 2-го процесса = 0. Теплота 1-го процесса – теплота плавления тв. в-ва Н2, пл . Если при расчете а2 в качестве станд. состояния 2-го компонента принята чист. жидкость, то 2о соотв. этому состоянию, а G = 2о – т равно изменению G для плавления 1 моля чистого 2-го компонента при Т ниже Т плавления; соответственно Н = Н2, пл
– RT
ln
a2,
нас
= Н2,
пл
+ Т –
R
ln
a2,
нас
– RT
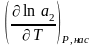
Н2,
пл
= RT2
;
=
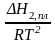
Для
ид. р-ров : а2
= N2
= N
d
lnN
=
dT
;
 =
=
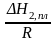
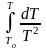
To
– Т плавления 2-го компонента (N
= 1); Т
То
lnN
= –
(
–
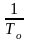 )
= –
+ B
)
= –
+ B
(линейная зав-ть lnN от 1/Т). В это уравнение не вх. величины, характеризующие растворитель идеальная растворимость вещества не зависит от природы растворителя. tg α = ∆H2, пл / R
По вышеприведенному уравнению и по графику можно рассчитать Н2, пл; в случае идеальной р-ти (н-р, р-р нафталина в нитробензоле) она приблизительно равна экспериментально найденным другими методами Н2, пл . |
Отклонения от ид. р-ти. Р-ть в реал. р-рах сильно отлич. от идеальной. В-ва сходной хим. природы часто имеют совершенно различные р-ти в том или ином р- ле. Современ. теоретические взгляды на взаимодействие компонентов в р-ре помогают качественно объяснить отдельные факты р-ти, но точно предсказывать величины р-ти какого-либо в-ва на основании данных для др. в-в пока невозможно. Общие закономерности ограничиваются качественными обобщениями, охватывающими лишь отд. классы р-ров. Известно, н-р, что неполярные в-ва лучше взаимно растворимы (так же, как и полярные), чем неполярное в-во в полярном растворителе и наоборот. Лишь для неполярных веществ (гл. образом, органических), р-ры которых обнаруживают небольш. полож. отклонения от з. Рауля, удается построить полуколичественную статистическую теорию растворимости. Сложное взаимодействие факторов, определяющих р-ть, приводит к тому, что в некот. случаях р-ть уменьшается с ↑ Т, тогда как кол-венные теории предсказывают ↑ раств-ти с Т.
Зав-ть р-ти тв. в-в от Р. Представление о малом влиянии Р на р-ть тв. тел в жидкостях справедливо лишь при небольших Р. В наст. время доступный для исследования диапазон Р расширился до десятков тысяч атмосфер и влияние Р на р-ть оказалось значительным.:
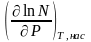 =
–
=
–
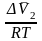 – уравнение
Планка
– Ван-Лаара
– уравнение
Планка
– Ван-Лаара
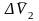 =
=
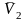 –
–
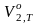 – прирост объема при растворении 1
моля тв. в-ва в его насыщ. р-ре. Уравнение
применимо к ид. и предельно разбавл.
р-рам.
– прирост объема при растворении 1
моля тв. в-ва в его насыщ. р-ре. Уравнение
применимо к ид. и предельно разбавл.
р-рам.
