
- •Б. 11. 1.Уравнения max работы Гиббса-Гельмгольца, их вывод и анализ.
- •Б.11.2.Активности компонентов раствора. 3 шкалы активности.
- •Б.12.1.Статистический хар-р 2 закона термодинамики. Ур. Больцмана, его вывод и анализ.
- •Б.12.2.Осмос. Вывод уравнения для расчета осмотического давления.
- •Б. 13.1.Термодин. Потенциалы идеальных и реал. Газов. Летучесть реал. Газа и ее расчет.
- •Б.13.2. Гетерог. Равновесия. Составл. В-ва системы, комп-ты, фазы, степ. Свободы. Правило фаз.
- •Б.14.1.Фаз. Переходы I рода для индив. В-в. Урав. Клапейрона-Клаузиуса. Фаз. Переходы II рода.
- •Б.14.2. Диаграммы состояния воды, серы, бензофенона.
- •Диаграмма состояния серы
- •Б. 15.1. Уравн. Для характер. Функций многокомпон. Систем, . Урав. Гиббса-Дюгема.
- •Б.15.2. Условия хим. Равновесия. Здм (вывод, анализ). Разл. Формы выражения к равн.
- •Б.16.1.Давление нас. Пара бинарных р-ров. Закон Рауля. Ид. Растворы. Предельно разбавл. Р-ры.
- •Б.16.2. Влияние т на хим. Равновесие. Уравн. Изохоры и изобары –ц-, их вывод, анализ, интегр-е.
- •Б. 17.1.Отклонения от законов идеальных растворов, причины отклонений.
- •Диаграмма сост. Системы, образ. Хим. Соединение, плавящееся инконгруентно (с разложением).
- •Б.18.1.Огр. Взаим. Р-ть жидкостей. Р-ть газов в жидкостях. З. Генри, Дальтона, Сеченова. Влияние t0.
- •Б.18.2.Трехкомпонентные системы. Способы изобр. Состава. Диаграмма с тройной эвтектикой.
- •Б.19.1.Растворимость тв. В-в в жидкостях. Уравнен. Р-ти в ид. И пред. Разб. Р-рах. Откл. От ид. Р-ти.
- •Б.19.2. Диаграмма состояния 2хкомпонентной системы с неогр. Взаимной р-тью компонентов.
Б.16.1.Давление нас. Пара бинарных р-ров. Закон Рауля. Ид. Растворы. Предельно разбавл. Р-ры.
Насыщ. пар содержит, в общ. случае, все компоненты р-ра, и Р насыщ. пара = парц. Р компонентов. Но часто отд. компоненты нелетучи при данной Т и отсут. в газ. фазе. Полное Р нас. пара и парц. Р явл. функциями Т и состава р-ра. При Т = const состояние бин. р-ра определ-ся лишь конц.1 из компонентов. Диаграмма Р – состав для р-ра 2х жидкостей, смешивающихся во всех
Р = РА + РВ
РоА РВ
РА
А В |
отношениях. РоА и РоВ – Р пара чистых жидкостей. Состав насыщ. пара определяется мольной долей 2-го компонента: N2 = Р2 / Р (Р2 – парц. давление 2-го компонента, Р – полное давление пара). Если насыщ. пар - ид. газ, то для компонентов пара: i = Gi (T) + RT ln pi ; 2 = G2 (T) + RT ln p2 Т.к. хим. потенциалы компонента в равновесных фазах равны, то это уравнение имеет силу и для жидкого раствора. Для чистого жидкого 2-го компонента при той же Т: о2 = Gо2 (T) + RT ln Ро2 ; Получаем: 2 = о2 (T) + RT ln (p2 / p20) |
При высоких Т и Р нас. пар р-ра не явл. ид. газом: 2 = о2 (T) + RT ln (f2 / f20); f2 – парциальная летучесть 2-го компонента в р-ре; f o2 – летучесть 2го компон. в виде чистой жидкости при той же Т.
ЗАКОН РАУЛЯ. В простейшем случае зав-ть парц. Р пара р-ля от состава бинарного р-ра:
Р1 = Ро1 N1 = Po1 (1 – N2 ) = Po1 (1 – N) Т.е. изображается на диаграмме P – N прямой линией.
З. Рауля : относительное понижение парц. Р пара р-ля = N раствор. в-ва N = ( P10 – P1) / P10 (1)
Закон применим к р-рам, нас. пар j ведет себя как ид. газ. Немногие р-ры подчиняются этому закону. Пока Р нас. пара невелико, отклонения от з. Рауля малы. При высоких Т, когда Р нас. пара велико, термодинам. св-ва газов нужно связывать с летучестями и з. Рауля выражать в след. форме:
f1
= f
о1
N1
= f
o1
(1
– N
)
; N
=
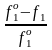 (2)
(2)
Р-ры, следующие з. Рауля в форме урав. (2) при всех конц. и всех Т, наз-ся идеальными (совершенными) р-рами; это предельный, простейший тип жидких р-ров. Для пара раствор. в-ва должно соблюд. урав., аналогичное вышеприведенному. Из уравнений (2) получаем:
d f1 = f o1 d (1 – N ) = – f o1 dN и подставляем в уравнение Дюгема-Маргулеса:
d
ln
f2
= –
d ln
f1
= –
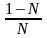 d ln
f1
= –
d ln
f1
= –
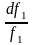 =
=
 =
=

d ln f2 = ; ln f2 = ln N + ln k ; f2 = kN (3) Если р-р ид., то (3) справедливо для всех конц.
При N =1 f2 = k = f o2 ; f2 = f o2 N. В неид. р-рах k f o2 Для многокомп. ид. р-ра: fi = f oi Ni (4)
При невысоких Т, когда парциальные давления компонентов невелики и летучести компонентов близки к их парциальным давлениям, возвращаемся к закону Рауля в форме уравнения (1), а уравнение (3) приобретает вид: Р2 = kN – з. Генри: парц. Р пара раствор. в-ва пропорционально его N. k – коэф. Генри. В ид. р-ре при малых Р нас. пара, когда f2 = P2, k = Po2 и P2 = P o2 N (6)
В общем виде для многокомпонентного ид. р-ра при невысоких Р: Pi = P oi Ni (7)
Р1 = Po1 (1 – N) P2 = P o2 N |
Эти 2 урав. отражают св-ва парц. давлений ид. р-ров при малых Р. (объединенный з. Рауля-Генри). |
Полное Р пара ид. бинарного р-ра: Р = Р1 + Р2 = Ро1 – (Ро1 – Ро2 )N ; Р – линейная функция N.
Примеры ид. р-ров : дибромпропан – дибромэтан, бензол – толуол, гексан – октан.
В
общ. случае составы ид. р-ра и его насыщ.
пара не совпадают:
N
=
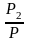 =
=
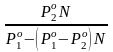
N – конц. 2-го компонента в паре; N = N при всех конц. только в том случае, если Ро1 = Ро2.
Для хим. потенциала компонента р-ра: 2 = о2 (T) + RT ln (P2/P20) ; 2 = о2 (T) + RT ln ( f2 / f20 )
Учитывая (из ур. (7) и (4)), что Pi / Poi = Ni , fi / f oi = Ni , получаем урав. для хим. потенциала компонента ид. жидк. р-ра, совпадающее по форме с урав. для i ид. газ. смеси: i = оi (T) + RT ln Ni
Часто Р пара р-ля при малых конц. остальных компонентов следуют з. Рауля и в р-рах, не явл. ид., т.е. в сильно разбавл. р-рах. Для них Р1=Po1 (1 – N) и одновременно P2 = kN , где k Р o2. Такие р-ры - предельно разбавленные. При образовании ид. р-ров из чистых жидких компонентов Q не погл. и не выдел., а V р-ра = сумме объемов жидких компонентов.

 Р
РоВ
Р
РоВ