
- •Б. 11. 1.Уравнения max работы Гиббса-Гельмгольца, их вывод и анализ.
- •Б.11.2.Активности компонентов раствора. 3 шкалы активности.
- •Б.12.1.Статистический хар-р 2 закона термодинамики. Ур. Больцмана, его вывод и анализ.
- •Б.12.2.Осмос. Вывод уравнения для расчета осмотического давления.
- •Б. 13.1.Термодин. Потенциалы идеальных и реал. Газов. Летучесть реал. Газа и ее расчет.
- •Б.13.2. Гетерог. Равновесия. Составл. В-ва системы, комп-ты, фазы, степ. Свободы. Правило фаз.
- •Б.14.1.Фаз. Переходы I рода для индив. В-в. Урав. Клапейрона-Клаузиуса. Фаз. Переходы II рода.
- •Б.14.2. Диаграммы состояния воды, серы, бензофенона.
- •Диаграмма состояния серы
- •Б. 15.1. Уравн. Для характер. Функций многокомпон. Систем, . Урав. Гиббса-Дюгема.
- •Б.15.2. Условия хим. Равновесия. Здм (вывод, анализ). Разл. Формы выражения к равн.
- •Б.16.1.Давление нас. Пара бинарных р-ров. Закон Рауля. Ид. Растворы. Предельно разбавл. Р-ры.
- •Б.16.2. Влияние т на хим. Равновесие. Уравн. Изохоры и изобары –ц-, их вывод, анализ, интегр-е.
- •Б. 17.1.Отклонения от законов идеальных растворов, причины отклонений.
- •Диаграмма сост. Системы, образ. Хим. Соединение, плавящееся инконгруентно (с разложением).
- •Б.18.1.Огр. Взаим. Р-ть жидкостей. Р-ть газов в жидкостях. З. Генри, Дальтона, Сеченова. Влияние t0.
- •Б.18.2.Трехкомпонентные системы. Способы изобр. Состава. Диаграмма с тройной эвтектикой.
- •Б.19.1.Растворимость тв. В-в в жидкостях. Уравнен. Р-ти в ид. И пред. Разб. Р-рах. Откл. От ид. Р-ти.
- •Б.19.2. Диаграмма состояния 2хкомпонентной системы с неогр. Взаимной р-тью компонентов.
Б.15.2. Условия хим. Равновесия. Здм (вывод, анализ). Разл. Формы выражения к равн.
Хим. реакции обратимы : наряду с хим. взаимодействием м/у исх. в-вами (прямая реакция) протекает хим. взаимодействие м/у продуктами реакции (обратная реакция), в рез. которого снова образ. исх. в-ва. По мере протекания -ц- скорость прямой реакции (кол-во молекул, прореагировавших за секунду) уменьшается, а скорость обратной реакции увел.. Когда обе скорости сравняются, наступает состояние хим. равновесия число молекул в-в, составляющих хим. систему, перестает меняться и остается постоян. во времени при неизменных внеш. усл.. Хим. равновесие явл. динамичным и подвижным с изменен. внешн. условий равновесие сдвигается в одну или в др. сторону; б/м изменение внешн. условий влечет за собой б/м изменение состояния равновесия. Т.о., хим. реакции могут протекать как равновесные –ц-, т.е. к ним можно применять общие условия термодинамич. равновесия.
Изменение G системы, в j протек. хим. реакция: dG = SdT + VdP + 1dn1 + 2dn2 + ...
Однако в этом случае изменения масс компонентов dn1, dn2 ... не являются независимыми, а связаны стехиометрическими соотношениями : 1А1 + 2А2 + ... = 1А1 + 2А2 + ...
Изменения масс компонентов, выраженные в молях, пропорциональны стехиомет. коэф. уравнения реакции, взятым с соответств. знаком («» для исчезающих в-в, «+» для образ.) :
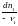 =
=
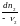 = ... =
= ... =
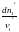 =
=
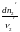 = ... = d
= ... = d
изменения масс исх. в-в изменения масс продуктов реакции
Отношение dni/i одинаково для всех участников хим. реакции и м.б. записано в форме дифференциала некоторой величины . хим. переменная : показывает m каждого компонента, вступившую к данному моменту в реакцию и измеренную в эквивалентных единицах, отвечающих уравнению реакции. характеризует только одну определ. хим. реакцию. Если в системе протекает несколько реакций, то для каждой из них имеется своя переменная (1 , 2 ...).
dG = VdP SdT 11d 22d ... + 11d + 22d + ... =
= VdP SdT + (ii)d
Здесь
G = G (P, T, )
,
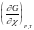 = ii
= ii
Част. произв. G по =алгеб. произведений ii . При P,T = const : (G)P,T = (ii)d
Для реакций, протекающих самопроизв. при P,T = const , dG 0 (ii) 0 , т.к. d 0. Когда реакция находится в состоянии равновесия, функция G = f () имеет min значение :
= i i = 0 условие хим. равновесия (в общей форме). Аналогично:
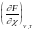 =
ii
= 0 в состоянии равновесия.
=
ii
= 0 в состоянии равновесия.
ЗДМ. Связь м/у равновесными концентрациями (или парц. давлениями) в-в, участвующих в хим. реакции, выражается ЗДМ, кол-венная формулировка и вывод были даны Гульдбергом и Вааге (1867).
1А1 + 2А2 1А1 + 2А2
v1
= k1
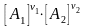
скорость прямой реакции
скорость прямой реакции
v2
= k2
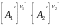
скорость обратной реакции
скорость обратной реакции
v1 = v2 в состоянии равновесия
k1 = k2
КС = k1 / k2 = /
(КС константа равновесия, выраженная через концентрации)
ЗДМ можно вывести из урав. ii = 0 , если химические потенциалы выразить как функции концентраций, парциальных давлений и т.д. компонентов, участвующих в реакции :
i
= Gi
(T) + RT ln
Ci

i = Gi(T) + RT ln Pi если компоненты идеальные газы
i = Gi(T,P) + RT ln Ni
i = i (T) + RT ln fi если компоненты реальные газы
i = io (T) + RT ln Ni если компоненты идеальные растворы
i = io (T) + RT ln ai если компоненты реальные растворы
Выведем ЗДМ для газовой реакции, если компоненты идеальные газы. Исходное уравнение i = Gi(T) + RT ln Pi подставим в уравнение ii = 0.
i Gi(T) + RT i ln рi, равн = 0
i
ln
рi,
равн
=
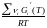 = f (T)
= f (T)
Опустим индекс (равн); заменим сумму логарифмов логарифмом произведения рi ; а f (T) логарифмом некоторой функции КР (Т) :
ln
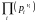 =
=
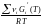 = ln
KP
(T)
= ln
KP
(T)
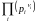 =
=
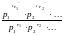 = KP
(T)
= KP
(T)
Величина КР, выраженная ч/з равновесные парц. давления в ид. газовой смеси, есть функция только Т и не зав. от суммарного Р и парц. давлений компонентов в исх. смеси. При T = const KP = const. КР константа хим. равновесия , а уравнение - закон действия масс.
Если
газ
реал., то таким же путем получим : Kf
=
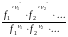 ; Kf
KP
при Р
0
; Kf
KP
при Р
0
В применении к конкр. хим. реакции: N2 + 3H2 2NH3
KP
=
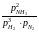 ; Kf
=
; Kf
=
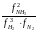
Вид выражения для КР и ее числ. значение зав. от того, в каком направлении и для каких кол-в записано стехиометрическое уравнение реакции :
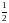 N2
+
N2
+
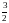 H2
NH3
2NH3
N2
+ 3H2
H2
NH3
2NH3
N2
+ 3H2
КР
=
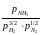 =
=
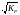 КР
=
КР
=
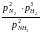 =
=
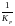
Необх. различать Кр, выраженные разн. способами, т.к. их числ. значения разные.
KP
=
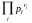 ; KC
=
; KC
=
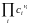 ; KN
=
; KN
=
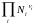
Связь м/у ними можно установить, используя уравнения для ид. газовой смеси : Pi = CiRT KP = KC (RT) Pi = NiP KP = KN P
= 1 + 2 + 3 + ... 1 2 3 ...
Т.к. КР не зависит от Р (для ид. газов), то и КС от него не зависит. KN же зависит от Р и не зав. от исх. кол-в компонентов. Если = 0, т.е. реакция протекает без изменения числа молекул, то КР = КС = КN .
