
- •Вопрос 2. Стандартный водородный электрод. Зависимость потенциала водородного электрода от Ph раствора.
- •Вопрос 2. Электроды второго рода (Хлорид серебряный электрод). Измерение электродных потенциалов металлов.
- •Вопрос 3. Направленность химической связи. Типы гибридизации атомных орбиталей. Структура простейших молекул.
- •Вопрос 1. Направленность химической связи. Типы гибридизации атомных орбиталей. Структура простейших молекул.
- •Вопрос 1. Направленность химической связи. Типы гибридизации атомных орбиталей. Структура простейших молекул.
- •Вопрос 3. Свободная энергия Гиббса, Гельмгольца. Условия самопроизвольного протекания процессов в изобарно-изотермических и изохорно-изотермических условиях.
- •Вопрос 1. Полярность химической связи. Дипольный момент связи. Полярность и дипольный момент молекул.
- •Вопрос 3. Стандартный водородный электрод. Зависимость потенциала водородного электрода от Ph раствора.
- •Вопрос 2. Стандартный водородный электрод. Зависимость потенциала водородного электрода от Ph раствора.
- •Вопрос 3. Направленность химической связи. Типы гибридизации атомных орбиталей. Структура простейших молекул.
- •Вопрос 2. Электроды второго рода (Хлорид серебряный электрод). Измерение электродных потенциалов металлов.
- •Вопрос 3. Направленность химической связи. Типы гибридизации атомных орбиталей. Структура простейших молекул.
- •Вопрос 3. Направленность химической связи. Типы гибридизации атомных орбиталей. Структура простейших молекул.
- •Вопрос 3. Направленность химической связи. Типы гибридизации атомных орбиталей. Структура простейших молекул.
- •Вопрос 1. Направленность химической связи. Типы гибридизации атомных орбиталей. Структура простейших молекул.
Билет №1
1) Химическая термодинамика – это наука о превращениях различных форм энергии, проходящих между системой и ее окружающей средой.
Система – это тело или группа тел, мысленно или реально отделенное от окружающей среды.
Система: изолированная, закрытая, открытая.
Изолированная система – система, которая не обменивается с окружающей средой ни энергией, ни веществом (идеальное понятие).
Закрытая система – система, которая обменивается только энергией.
Открытая система – обменивается и энергией и веществом.
Система: -гомогенная (однофазная) и -гетерогенная (многофазная)
Фаза – однородная часть системы, имеющая поверхность раздела и обладающая одинаковыми физическими и химическими свойствами.
Совокупность всех физических и химических свойств системы характеризует её термодинамическое состояние. Все величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы – параметры состояния. Опытным путем установлено, что для однозначной характеристики данной системы необходимо использовать некоторое число параметров, называемых независимыми; все остальные параметры рассматриваются как функции независимых параметров.
Параметры состояния:
m – масса. Т– температура. V – объем. р– давление.U – внутр. энергия системы.
Функции состояния:
H – энтальпия. S – энтропия.
G – изобарно-изотермический потенциал (свободная энергия Гиббса).
F – изохорно-изотермический потенциал (свободная энергия Гельмгольца).
μ – химический потенциал.
Параметры состояния делятся на интенсивные (не зависят от массы: T, p, разность потенциалов) и экстенсивные (зависят от массы: V,S,H,U). Интенсивные параметры выравниваются, а экстенсивные складываются.
Всякое изменение хотя бы одного параметра состояния называется термодинамическим процессом.
При переходе системы из одного состояния в другое изменяются некоторые ее свойства, в частности внутренняя энергия U.
Внутренняя энергия – это совокупность всех видов энергии тела, за исключением потенциальной энергии системы, как единого целого.
∆U= U2 – U1 ∆U | = |Qv| ∆U = -Qv
Тепловой эффект реакции – это теплота, которая выделяется или поглощается в результате реакции.
Экзотермический – Q>0 U1 > U2 U1 < U2
Эндотермический – Q<0 ∆U < 0, Qv > 0 ∆U > 0, Qv < 0
Энтальпия.
H = U +pV
1-ый физический смысл энтальпии – энергия расширенной системы.
H1 – H2 = ∆H
∆H = -Qp
2-ой смысл энтальпии – тепловой эффект реакции при постоянном давлении.
Hº298 - стандартная энтальпия одного или больше вещества, взятого из простых веществ при T = 298К и p = 1 атм. (101кПа).
Энтальпия простого вещества = 0
Закон Гесса. Изменение энтальпии зависит только от начального и конечного состояния системы и не зависит от пути протекания процесса.
Следствие из закона Гесса. Тепловой эффект химической реакции равен сумме теплот образования конечных веществ – минус сумма теплот образования исходных веществ с учетом их стехиометрических коэффициентов.
2) Расчеты в квантовой механике производят с помощью предложенного в 1926 г. австрийским ученым Э. Шредингером уравнения, которое является математическим описанием электронного строения атома в трехмерном пространстве.
-(h²/8π²m)(∂²ψ/∂x² + ∂²ψ/∂y² + ∂²ψ/∂z²) + Uψ = Eψ
Решая уравнение Шредингера, находят волновую функцию ψ = f (x,y,z). Решение возможно лишь при определенных значениях полной энергии E. Определив вероятностную функцию ψ, можно оценить величину |ψ|²dV – вероятность нахождения электрона в объеме пространства dV, окружающего атомное ядро.
Как следует из решения уравнения Шредингера для атома водорода, квантовое состояние электрона в этом атоме (можно сказать и квантовое состояние атома) полностью определяется заданием трех квантовых чисел.
Каждое из квантовых чисел принимает только целочисленные значения и определяет, то есть предсказывает результаты измерения основных физических величин в заданном квантовом состоянии атома.
Главное квантовое число n определяет энергию электрона и размеры электронных облаков. Энергия электрона главным образом зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия. Поэтому можно сказать, что главное квантовое число n определяет расположение электрона на том или ином энергетическом уровне (квантовом слое). Главное квантовое число имеет значения ряда целых чисел от 1 до ∞. При значении главного квантового числа, равного единице (n=1), электрон находится на первом энергетическом уровне, расположенном на минимально возможном расстоянии от ядра. Полная энергия такого электрона наименьшая.
Электрон, находящийся на наиболее удаленном от ядра энергетическом уровне, обладает максимальной энергией. Поэтому при переходе электрона с более удаленного энергетического уровня на более близкий выделяются порции (кванты) энергии.
Орбитальное квантовое число l. Электронные облака отличаются не только размерами, но и формой. Форму характеризует орбитальное или азимутальное квантовое число. Различная форма электронных облаков обусловливает изменение энергии электронов в пределах одного энергетического уровня, т.е. ее расщепление на энергетические подуровни. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, с одинаковыми n и l - подуровнем.
Для:
l=0 s-подуровень, s-орбиталь – орбиталь сфера.
l=1 p-подуровень, p-орбиталь – орбиталь гантель.
l=2 d-подуровень, d-орбиталь – орбиталь сложной формы
f-подуровень, f-орбиталь – орбиталь еще более сложной формы.
На первом энергетическом уровне (n = 1) орбитальное квантовое число l принимает единственное значение l = (n - 1) = 0. Форма обитали - сферическая; на первом энергетическом только один подуровень - 1s. Для второго энергетического уровня (n = 2) орбитальное квантовое число может принимать два значения: l = 0, s- орбиталь - сфера большего размера, чем на первом энергетическом уровне; l = 1, p- орбиталь - гантель. Таким образом, на втором энергетическом уровне имеются два подуровня - 2s и 2p. Для третьего энергетического уровня (n = 3) орбитальное квантовое число l принимает три значения: l = 0, s- орбиталь - сфера большего размера, чем на втором энергетическом уровне; l = 1, p- орбиталь - гантель большего размера, чем на втором энергетическом уровне; l = 2, d- орбиталь сложной формы.
Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня - 3s, 3p и 3d.
Магнитное квантовое число m характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -l до +l, включая 0. Это означает, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве.
Для s-орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве.
Для p-орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): m = -1, 0, +1.
Для d-орбитали (l = 2) - пять равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2.
Таким образом, на s-подуровне - одна, на p-подуровне - 3, на d-подуровне - 5, на f-подуровне - 7 орбиталей.
Вопрос 3.Скоростью химической реакции называют изменение концентрации вещества за единицу времени. Скорость химической реакции зависит от природы химических веществ, от концентрации, от давления, от температуры, от присутствия катализатора. Осн закон химической кинетики. При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
aA+bB=cC
V=k[A]a *[B]b [A]-концентрация
Билет №2
1) V = k [A]^a * [B]^b
V = k PA^a * PB^b
K – константа скорости (не зависит от концентрации и давления а зависит от присутствия катализатора).
Кинетическое уравнение – математическое выражение, устанавливающее зависимость скорости химической реакции от концентрации веществ в реагирующей системе.
2) Правило Хунда: в данном подуровне электрон стремится занять энергетические состояния таким образом, чтобы суммарный спин был максимальным.
Принцип Паули: в атоме не может быть двух электронов, у которых были бы одинаковые все четыре квантовых числа. Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа: x = 2πn².
Правило Клечковского: общий запас энергии, а значит и последовательное заполнение энергетических уровней происходит в порядке возрастания суммы чисел n + l, а при равных значениях n + l – в порядке возрастания n:
1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈5d≈4f<6p и т.д.
Поведение электронов в атомах подчиняется принципу запрета, сформулированному в 1925 г. В. Паули: в атоме не может быть двух электронов, у которых были бы одинаковые все четыре квантовых числа.
Согласно принципу Паули, на одной орбитали, характеризуемой определенными значениями трех квантовых чисел n, l и ml, могут находится только два электрона отличающихся значением спинового квантового числа ms, а именно ms = +1/2 и ms = -1/2. Действительно, если n = 1, то l и ml могут иметь только нулевые значения. Поэтому электроны с n = 1 могут отличаться только значением спинового квантового числа. Следовательно на первом энергетическом уровне могут находиться только два электрона. На втором энергетическом уровне электроны занимают два подуровня.
Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа: x = 2πn².
Энергетические уровни и подуровни, которые содержат максимально допустимое число электронов, называют замкнутыми. Замкнутый s-подуровень (l=0) содержит 2 электрона, замкнутый p-подуровень (l=1) содержит 6 электронов, в замкнутом d-подуровне (l=2) находится 10 электронов, в замкнутом f-подуровне (l=3) – 14 электронов и т.д.
При заполнении электронами энергетических подуровней соблюдается правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным.
3)??????????????????????????????????????????
Билет №3
1) Зависимость скорости реакции от концентрации реагентов.
Чтобы произошла реакция, необходимо столкновение реагирующих частиц. При одной и той же температуре число столкновений растёт с увеличением числа реагирующих частиц в единице объёма, т.е. с возрастанием концентрации реагентов. Соответственно скорость реакции повышается с увеличением концентраций реагирующих веществ. Скорость необратимой реакции bB+dD=lL+mM
равна v=k*cB^nB*cD^nD (Серега советует переписать это на листик =))) )
где k-константа скорости реакции; nB и nD – коэффициэнты, называемые порядками реакции по веществам B и D. Уравнение называется кинетическим уравнением химической реакции.
Константа скорости реакции k не зависит от концентрации реагентов, но зависит от их природы и температуры. Из уравнения следует, что при cD=cB=1 (например, 1 моль/л) константа скорости реакции численно равна скорости реакции. Из этого же уравнения видно, что размерность константы скорости реакции зависит от порядка реакции, поскольку размерность скорости реакции для всех гомогенных реакций одинакова.
Например, для реакции диссоциации молекулы А2=2А для которой
v=kcА2 , (nA=1),
единицу измерения константы скорости реакции можно определить, исходя из анализа размерностей: [моль*л^-1*c^-1] = [x] * [моль*л^-1]. Соответственно [x]=[c^-1].
Итак, скорость реакции пропорциональна произведению концентраций реагентов в степенях, называемых порядками реакции по реагентам.
Основной постулат кинетики: Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора.
Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики - законом действующих масс: скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
![]() ,
,
где k - константа скорости (не зависящая от концентрации); x, y - некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство
химических реакций состоит из нескольких
стадий, называемых элементарными
реакциями.
Под элементарной реакцией обычно
понимают единичный акт образования или
разрыва химической связи, протекающий
через образование переходного комплекса.
Число частиц, участвующих в элементарной
реакции, называют молекулярностью
реакции.
Элементарные реакции бывают только
трех типов: мономолекулярные (A
![]() B
+ ...), бимолекулярные (A + B
D
+ ...) и тримолекулярные (2A + B
D
+ ...). Для элементарных реакций общий
порядок равен молекулярности, а порядки
по веществам равны коэффициентам в
уравнении реакции.
B
+ ...), бимолекулярные (A + B
D
+ ...) и тримолекулярные (2A + B
D
+ ...). Для элементарных реакций общий
порядок равен молекулярности, а порядки
по веществам равны коэффициентам в
уравнении реакции.
Одностадийные реакции.
Относительно небольшое число реакций протекает в одну стадию. К ним можно отнести, например
Реакции диссоциации
H2=2H, Cl2=2Cl, 2HI=H2+I2
Взаимодействие йода и водорода
I2+H2=2HI
Взаимодействие монооксида азота с водородом и озоном
2NO+H2=N2O+H2O
NO+O3=NO2+O2
Одностадийные реакции, как и сложные реакции, протекают, как правило через образование активированного комплекса. Для одностадийных реакций порядок реакций совпадает с молекулярностью реакции, т.е. мономолекулярные, бимолекулярные и тримолекулярные реакции являются соответственно реакциями первого, второго и третьего порядка. Кинетическое уравнение одностадийной химической реакции совпадает с законом действующих масс.
Сложные химические реакции.
К сложным относятся реакции, протекающие последовательно через несколько стадий, или параллельно. Большинство реакций являются многостадийными. Например, реакция
2А+3В=А2В3
Может идти через стадии
А+В=АВ (1)
А+АВ=А2В (2)
А2В+2В=А2В3 (3)
2А+3В=А2В3
Если одна из этих стадий будет протекать значительно медленнее других, то она будет определять скорость всего процесса, и её называют лимитирующей стадией. Скорость всей реакции будет определяться скоростью лимитирующей стадии. Например, если лимитирующй будет стадия (1), то скорость этой стадии и соответственно всей реакции будет равна v=k*cA*cB.
В данном случае n=1+1=2, т.е. порядок реакции меньше суммы стехиометрических коэффициентов (5). Обычно лимитирующая стадия записывается как необратимая реакция, а другие стадии как обратимые реакции. Например, реакция разложения пентаоксида азота N2O5
2N2O5=4NO2+O2
Протекает через следующие стадии
N2O5 >< (это типа 2 стрелочки, т.е. обратимая) NO2+NO3 (быстрая стадия)
NO2+NO3 > NO2+NO+O2 (медленная стадия)
NO+NO3 >< 2NO2 (быстрая стадия)
Первая стадия мономолекулярная, вторая и третья - бимолекулярные. Лимитирующей является вторая стадия. В ходе реакции образуются промежуточные короткоживущие частицы (интермедиаты) NO3 и NO2. Для нахождения уравнения скорости реакции принимают, что устанавливается стационарная концентрация промежуточных частиц на основании предположения, что скорость образования интермедиатов равна скорости их расходования. Вследствие такого предположения можно определить скорость лимитирующей стадии и соответственно скорость всей реакции. Например, определив концентрацию интермедиатов (NO2 и NO3), получим, что скорость второй стадии и соответственно скорости всей рассматриваемой реакции равна V=k*cN2O5
Как видно, порядок этой реакции (первый) меньше суммы стехиометрических коэффициентов (2). Порядок реакции (1) отличается от молекулярности второй и третьей стадий (2).
2)????????????????????????????
3) Электролизом называется процесс разложения вещества электрическим током. Сущность электролиза заключается в том, что при пропускании тока через раствор электролита (или расплавленный электролит) положительно заряженные ионы перемещаются к катоду, а отрицательно заряженные – к аноду. Достигнув электродов, ионы разряжаются, в результате чего у электродов выделяются составные части растворенного электролита или водород и кислород из воды.
Для перевода различных ионов в нейтральные атомы или группы атомов требуется различное напряжение электрического тока. Одни ионы легче теряют свои заряды, другие труднее. Степень легкости, с которой разряжаются (присоединяют электроны) ионы металлов, определяется положением металлов в ряду напряжений. Чем левее стоит металл в ряду напряжений, чем больше его отрицательный потенциал (или меньше положительный потенциал), тем труднее при прочих равных условиях разряжаются его ионы. Если в растворе одновременно находятся ионы нескольких металлов, то в первую очередь разряжаются ионы того металла, у которого отрицательный потенциал меньше (или положительный – больше). Но величина потенциала металла зависит также и от концентрации его ионов в растворе; точно также изменяется и легкость разряда ионов каждого металла в зависимости от их концентрации: увеличение концентрации облегчает разряд ионов, уменьшение – затрудняет. Поэтому при электролизе раствора, содержащего ионы нескольких металлов может случиться, что выделение более активного металла будет происходить раньше, чем выделение менее активного (если концентрация ионов первого металла значительна, а второго – очень мала).
При наличие нескольких видов ионов или недиссоциированных молекул электрохимически активных веществ возможно протекание нескольких электродных реакций. Т.к. на катоде идет реакция восстановления, т.е. прием электронов окислителем, то в первую очередь должны реагировать наиболее сильные окислители. На катоде прежде всего протекает реакция с наиболее положительным потенциалом.
Перенапряжением электрода называют разность между фактическим и теоретическим электродными потенциалами. Перенапряжение металлов настолько мало, что им пренебрегают. Велико перенапряжение водорода и кислорода. Перенапряжение водорода велико при следующих условиях:
малых плотностях тока, низких температурах раствора. Перенапряжение также зависит от материала катода. Перенапряжение водорода может играть как отрицательную, так и положительную роль. Отрицательную роль оно играет при необходимости получить водород электролитическим путем. Положительна роль перенапряжения при необходимости получить с помощью электролиза какой - либо металл, находящийся в ряду напряжений до водорода. Можно создать условия (плотность тока, температура раствора, материал катода, посторонние ионы в растворе), при которых вследствие высокого перенапряжения водорода из раствора можно восстановить металлы, стоящие в ряду напряжения до водорода, (вплоть до алюминия).
Билет №4
1) Энергия ионизации. Энергия, необходимая для удаления одного моля электронов от одного моля атомов какого либо элемента, называется первой энергией ионизации I1.
В результате ионизации атомы превращаются в положительно заряженные ионы. Энергию ионизации выражают либо в килоджоулях на моль (кДж/моль), либо в электронвольтах (эВ).
Энергия ионизации характеризует восстановительную способность элемента. Первая энергия ионизации определяется электронным строением элементов и её изменение имеет периодический характер. Энергия ионизации возрастает по периоду. Наименьшие значения энергии ионизации имеют щелочные элементы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода. Пики на кривой зависимости энергии ионизации от порядкового номера элемента наблюдаются у элементов с законченными s-подоболочками (Be, Mg) и d-подоболочкой (Zn,Cd,Hg), и p-подоболочкой, в АО которой аходится по одному электрону (N, P, As). Минимумы на кривой наблюдаются у элементов, имеющих на внешней подоболочке по одному электрону (щелочные металлы B, Al, Ga, In).
В одной и той же группе энергия ионизации несколько уменьшается с увеличением порядкового номера элемента, что обусловливается увеличением размера атомов и расстояния внешних подоболочек от ядра.
Кроме первой энергии ионизации, элементы с многоэлектронными атомами могут характеризоваться второй I2, третьей I3 и более высокой энергией ионизации, которые равны соответственно энергии отрыва молей электронов от молей ионов Э^+(Это Э в степени + пишется), Э^2+ и т.д. Энергии ионизации возрастают с увеличением их номеров, т.е. I1< I2< I3. Особенно резкое увеличение энергии ионизации наблюдается при отрыве электронов из заполненной подоболочки.
Сродство к электрону.
Энергия, которая выделяется при присоединении моля электронов к молю атомов, называется сродством к электрону.
Э + e = Э^- (Э в степени минус).
Сродство к электрону Eср количественно выражается в кДж/моль или эВ/моль. Сродство к электрону зависит от положения элемента в периодической системе. Наибольшие значения сродства к электрону имеют галогены, кислород, сера, наименьшие и даже отрицательные значения её – элементы с электронной конфигурацией s^2 (He, Be, Mg, Zn), с полностью или наполовину заполненными p-подоболочками (Ne, Ar, Kr, N, P, As).
Электроотрицательность.
Электpоoтрицательность () - способность атома удерживать внешние (валентные) электроны. Она определяется степенью притяжения этих электронов к положительно заряженному ядру.
Это свойство проявляется в химических связях как смещение электронов связи в сторону более электроотрицательного атома.
Электpоотрицательность атомов, участвующих в образовании химической связи, - один из главных факторов, который определяет не только ТИП, но и СВОЙСТВА этой связи, и тем самым влияет на характер взаимодействия между атомами при протекании химической реакции.
В шкале относительных электроотрицательностей элементов Л.Полинга (рассчитанных на основании зависимости энергий связей от различий в электроотрицательностях связываемых атомов) металлы и элементы-органогены располагаются в следующий ряд:
Элемент |
K |
Na |
Li |
Mg |
H |
S |
C |
J |
Br |
Cl |
N |
O |
F |
|
0.8 |
0.9 |
1.0 |
1.2 |
2.1 |
2.5 |
2.5 |
2.5 |
2.8 |
3.0 |
3.0 |
3.5 |
4.0 |
Электроотрицательность не является абсолютной константой элемента. Она зависит от эффективного заряда ядра атома, который может изменяться под влиянием соседних атомов или групп атомов, типа атомных орбиталей и характера их гибридизации.
Электроотрицательность элементов возрастает по периоду и несколько убывает в группах с возрастанием номера периода у элементов I, II, V, VI и VII главных подгрупп, III, IV и V – побочных подгрупп, имеет сложную зависимость у элементов III главной подгруппы (минимум ЭО у Al), возрастает с увеличением номера периода у элементов VII-VIII побочных подгрупп. Наименьшие значения ЭО имеют s-элементы I подгруппы, наибольшие – p-элементы VII и VI групп.
2) Если потенциал металлического анода имеет более отрицательное значение, чем потенциал ионов OH или других веществ, присутствующих в растворе, в газовой фазе около электрода или на электроде, то происходит растворение металла. При этом протекает электролиз с растворимым анодом. Если потенциал металлического анода близок к потенциалу других электродных процессов, то наряду с растворением металла на аноде протекают также другие процессы, например разряд ионов OH. В этом случае также говорят об электролизе с растворимым анодом, но учитывают и другие анодные процессы. Если потенциал металла или другого проводника первого рода, используемого в качестве анода, имеет более положительное значение, то протекает электролиз с нерастворимым анодом. качестве нерастворимых анодов применяют золото и платиновые металлы, диоксид свинца, оксид рутения и другие вещества, имеющие положительные значения равновесных электродных потенциалов, а также графит. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например никель и железо в щелочном растворе, свинец в H2SO4, титан, тантал, нержавеющая сталь. Явление торможения анодного растворения металла из-за образования защитных слоев называется пассивностью металла.
При электролизе с нерастворимым анодом на электроде может окисляться ион OH, или другие ионы, или недиссоциированные молекулы восстановителей, присутствующие в растворе.
3) V = k [A]^a * [B]^b
V = k PA^a * PB^b
K – константа скорости (не зависит от концентрации и давления а зависит от присутствия катализатора).
Кинетическое уравнение – математическое выражение, устанавливающее зависимость скорости химической реакции от концентрации веществ в реагирующей системе.
Билет №5
1.II закон термодинамики для изолированной системы.В изолированной системе процесс идёт самопроизвольно в сторону возрастания энтальпии до её максимального значения.
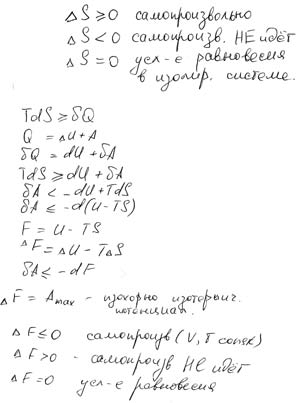
В закрытых системах процесс идёт самопроизвольно в сторону уменьшения изохороно-изотермического потенциала до его минимального значения.

3) V = k [A]^a * [B]^b
V = k PA^a * PB^b
K – константа скорости (не зависит от концентрации и давления а зависит от присутствия катализатора).
Кинетическое уравнение – математическое выражение, устанавливающее зависимость скорости химической реакции от концентрации веществ в реагирующей системе.
Билет №6
Вопрос 2. Стандартный водородный электрод. Зависимость потенциала водородного электрода от Ph раствора.
Стандартный водородный электрод - это специально сконструированной электрод, в котором происходит окислительно-восстановительная реакция: 2Н+ + 2е « Н2. При этом концентрация ионов водорода является одномолярной, давление водорода равняется 1 атм. и поддерживается температура 25°С.
Стандартный водородный электрод(СВЭ).Сейчас за нуль принят потенциал СВЭ. Он относится к газовым электродам, т.е. к электродам, в котором по крайней мере один из реагентов является газообразным. Т.к. для протекания электродн. реакции необходим подвод и отвод электронов, то газовые электроды содержат проводники 1го рода. В качестве проводника 1го рода СВЭ служит платина. При контакте с молекулярным водородом происходит адсорбция водорода на платине. Адсорбированный водород переходит в раствор в виде ионов, оставляя в платине электроны. При этом платина заряжается отрицательно, а раствор – положительно. Возникает скачок потенциалов между платиной и раствором. Наряду с переходом ионов в раствор идёт обратный процесс восстановления ионов H(+) с образованием молекул водорода.
2H(+) +2е H2
Абсолютное значение потенциала водородного электрода неизвестно, но условно считают за нуль потенциал СВЭ т.е. пртенциал при pH2 =1 ( 101КПа) и aH+ =1 моль/л.
Вопрос 3.Скоростью химической реакции называют изменение концентрации вещества за единицу времени. Скорость химической реакции зависит от природы химических веществ, от концентрации, от давления, от температуры, от присутствия катализатора. Осн закон химической кинетики. При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
aA+bB=cC
V=k[A]a *[B]b [A]-концентрация
Билет №7
Вопрос 1.Скоростью химической реакции называют изменение концентрации вещества за единицу времени. Скорость химической реакции зависит от природы химических веществ, от концентрации, от давления, от температуры, от присутствия катализатора. Осн закон химической кинетики. При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
aA+bB=cC
V=k[A]a *[B]b [A]-концентрация
Билет №8
1) Зависимость скорости реакции от концентрации реагентов.
Чтобы произошла реакция, необходимо столкновение реагирующих частиц. При одной и той же температуре число столкновений растёт с увеличением числа реагирующих частиц в единице объёма, т.е. с возрастанием концентрации реагентов. Соответственно скорость реакции повышается с увеличением концентраций реагирующих веществ. Скорость необратимой реакции bB+dD=lL+mM
равна v=k*cB^nB*cD^nD (Серега советует переписать это на листик =))) )
где k-константа скорости реакции; nB и nD – коэффициэнты, называемые порядками реакции по веществам B и D. Уравнение называется кинетическим уравнением химической реакции.
Константа скорости реакции k не зависит от концентрации реагентов, но зависит от их природы и температуры. Из уравнения следует, что при cD=cB=1 (например, 1 моль/л) константа скорости реакции численно равна скорости реакции. Из этого же уравнения видно, что размерность константы скорости реакции зависит от порядка реакции, поскольку размерность скорости реакции для всех гомогенных реакций одинакова.
Например, для реакции диссоциации молекулы А2=2А для которой
v=kcА2 , (nA=1),
единицу измерения константы скорости реакции можно определить, исходя из анализа размерностей: [моль*л^-1*c^-1] = [x] * [моль*л^-1]. Соответственно [x]=[c^-1].
Итак, скорость реакции пропорциональна произведению концентраций реагентов в степенях, называемых порядками реакции по реагентам.
Основной постулат кинетики: Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора.
Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики - законом действующих масс: скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
,
где k - константа скорости (не зависящая от концентрации); x, y - некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают только трех типов: мономолекулярные (A B + ...), бимолекулярные (A + B D + ...) и тримолекулярные (2A + B D + ...). Для элементарных реакций общий порядок равен молекулярности, а порядки по веществам равны коэффициентам в уравнении реакции.
Одностадийные реакции.
Относительно небольшое число реакций протекает в одну стадию. К ним можно отнести, например
Реакции диссоциации
H2=2H, Cl2=2Cl, 2HI=H2+I2
Взаимодействие йода и водорода
I2+H2=2HI
Взаимодействие монооксида азота с водородом и озоном
2NO+H2=N2O+H2O
NO+O3=NO2+O2
Одностадийные реакции, как и сложные реакции, протекают, как правило через образование активированного комплекса. Для одностадийных реакций порядок реакций совпадает с молекулярностью реакции, т.е. мономолекулярные, бимолекулярные и тримолекулярные реакции являются соответственно реакциями первого, второго и третьего порядка. Кинетическое уравнение одностадийной химической реакции совпадает с законом действующих масс.
Сложные химические реакции.
К сложным относятся реакции, протекающие последовательно через несколько стадий, или параллельно. Большинство реакций являются многостадийными. Например, реакция
2А+3В=А2В3
Может идти через стадии
А+В=АВ (1)
А+АВ=А2В (2)
А2В+2В=А2В3 (3)
2А+3В=А2В3
Если одна из этих стадий будет протекать значительно медленнее других, то она будет определять скорость всего процесса, и её называют лимитирующей стадией. Скорость всей реакции будет определяться скоростью лимитирующей стадии. Например, если лимитирующй будет стадия (1), то скорость этой стадии и соответственно всей реакции будет равна v=k*cA*cB.
В данном случае n=1+1=2, т.е. порядок реакции меньше суммы стехиометрических коэффициентов (5). Обычно лимитирующая стадия записывается как необратимая реакция, а другие стадии как обратимые реакции. Например, реакция разложения пентаоксида азота N2O5
2N2O5=4NO2+O2
Протекает через следующие стадии
N2O5 >< (это типа 2 стрелочки, т.е. обратимая) NO2+NO3 (быстрая стадия)
NO2+NO3 > NO2+NO+O2 (медленная стадия)
NO+NO3 >< 2NO2 (быстрая стадия)
Первая стадия мономолекулярная, вторая и третья - бимолекулярные. Лимитирующей является вторая стадия. В ходе реакции образуются промежуточные короткоживущие частицы (интермедиаты) NO3 и NO2. Для нахождения уравнения скорости реакции принимают, что устанавливается стационарная концентрация промежуточных частиц на основании предположения, что скорость образования интермедиатов равна скорости их расходования. Вследствие такого предположения можно определить скорость лимитирующей стадии и соответственно скорость всей реакции. Например, определив концентрацию интермедиатов (NO2 и NO3), получим, что скорость второй стадии и соответственно скорости всей рассматриваемой реакции равна V=k*cN2O5
Как видно, порядок этой реакции (первый) меньше суммы стехиометрических коэффициентов (2). Порядок реакции (1) отличается от молекулярности второй и третьей стадий (2).
