
- •Термодинамическое описание поверхности
- •Поверхностная энергия раздела фаз
- •Способы определения поверхностного натяжения жидкостей
- •Методы определения поверхностного натяжения твердого тела
- •Динамическое поверхностное натяжение
- •Адсорбция полимеров
- •Влияние химического состава и кристаллической структуры твердых тел на свойства поверхности
- •Кислотно-основные свойства поверхности
- •Классификация пав
- •Важнейшие свойства пав
- •4) Точка Крафта
- •Смачивание и растекание жидкости
- •Факторы адгезионного взаимодействия
- •Методы определения адгезионной прочности
- •1.3 Укрывистость
- •1.4 Красящая и разбеливающая способность пигментов
- •1.5 Влияние размера и формы частиц на оптические свойства пигментированного лакокрасочного материала
- •2 Цвет лакокрасочных материалов и его расчет
- •2.1. Механизм зрения
- •2.1.1 Цветовое зрение
- •2.1.2 Нарушение цветового зрения
- •2.2 Источники света. Цветовая температура
- •2.3 Природа цвета
- •2.4 Аддитивное и субтрактивное смешение цветов
- •2.5 Метрология цвета
- •2.5.1 Основные понятия и определения
- •2.5.2 Неравноконтрастные колористичекие системы
- •2.5.2.1 Система r, g,в
- •6.2.2 Колористическая система xyz
- •2.5.3 Колористическая система ciel*a*b*
- •2.5.4 Метамеризм
- •2.6 Расчет цветовых характеристик. Метод взвешенных и избранных ординат
- •2.6.1 Геометрия измерения
- •2.6.2 Аппаратура
- •2.6.3 Расчет координат цвета по способу взвешенных ординат
- •2.6.3 Расчет координат цвета по способу избранных ординат
- •2.6.4 Расчет цветового различия
- •2.6.4 Оценка белизны
- •2.6.5 Оценка желтизны
- •2.6.6 Оценка черноты
- •Задачи для самостоятельной подготовки студентов
- •Оптические свойства наполненных полимерных систем
- •Системы спецификаций
- •Атлас ncs
- •Диэлектрическая проницаемость
- •Электрическая прочность
- •Регулирование теплофизических свойств полимерных материалов
- •Учебники
- •Учебные пособия, учебные практикумы, справочники
Классификация пав
Ионогенные ПАВ
Катионные ПАВ - это соединения, которые в водных растворах диссоциируют с образованием катионов (положительно заряженных ионов), определяющих их поверхностную активность.
Катионактивные ПАВ меньше снижают поверхностное натяжение, чем анионахтивные, но они могут взаимод. химически с пов-стью адсорбента, напр. взаимод. полярных групп катионактивных ПАВ с гидроксильны-ми группами волокон целлюлозы приводит к гидрофобиза-ции волокон и импрегнированию тканей.
К ПАВ этого типа относятся:
а) соли первичных, вторичных и третичных алифатических и ароматических аминов;
б) соли алкилзамещенных аммониевых оснований.
Катионные ПАВ наиболее токсичные и наименее биологически разлагаемые.
Анионные ПАВ - это соединения, которые в водных растворах диссоциируют с образованием анионов (отрицательно заряженных ионов), обусловливающих их поверхностную активность.
К ПАВ этого типа относятся:
а) карбоновые кислоты и их соли (RCOOM, где М – металл);
б) алкилсульфонаты ROSO2OM;
в) алкиларилсульфонаты RArSO2OM;
г) фосфаты, тиофосфаты.
Амфолитные - это соединения, которые в водных растворах ионизируются и ведут себя в зависимости от условий (главным образом от рН среды), то есть, в кислом растворе действуют как катионоактивные, в щелочном – анионоактивные ПАВ.
Неионногенные ПАВ – не диссоциируют в растворах на ионы.
Поверхностная активность этих веществ обусловлена своеобразным строением их молекул, которые имеют асимметричную (дифильную) структуру, состоящую из полярных и неполярных групп. Неполярной и нерастворимой в воде частью молекулы являются гидрофобный алкильный, арильный или алк'иларильный радикал, а полярную водорастворимую группу представляет полиэтиленгликолевый или пропиленгликолевый остаток. Общая формула этих веществ:
R = CH2CH2OCH3CHaO. . .СН2СН3ОН,
где R может быть органической группой, например СбН4О-, СОО-, CONH-, CON- или атомом кислорода, серы и т. д.
Их р-римость обусловлена наличием в молекулах гидрофильных эфирных и гидроксильных групп, чаще всего полиэтиленгликолевой цепи. По-видимому, при растворении образуются гидраты вследствие образования водородной связи между кислородными атомами полиэтиленгликолевого остатка и молекулами воды. Вследствие разрыва водородной связи при повышении т-ры растворимость неионогенных ПАВ уменьшается, поэтому для них точка помутнения -верх. температурный предел мицеллообразования- является важным показателем.
Методы их получения основаны на реакции присоединения этиленоксида к спиртам, карбоновым кислотам, аминам, алкилфенолам и др. соединениям. Например, оксиэтилированные алкилспирты марки ОС синтезируют по реакции:

К ПАВ природного происхождения прежде всего относятся полярные липиды. Они широко распространены в живых организмах. В биологических системах поверхностно-активные вещества выполняют по сути те же функции, что и синтетические ПАВ в технических системах.
Так, например, они помогают организму преодолеть проблему растворимости малорастворимых веществ, являются эмульгаторами и диспергаторами, а также модификаторами поверхности и т. д. Можно привести много интересных примеров, характеризующих роль ПАВ в биологических системах. Так, соли желчных кислот являются чрезвычайно эффективными солюбилизаторами гидрофобных компонентов крови смеси.
В растворах ПАВ чаще всего ассоциированы и образуют мицеллы.
МИЦЕЛЛООБРАЗОВАНИЕ, самопроизвольная ассоциация молекул ПАВ в р-ре. В результате в системе ПАВ-р-ри-тель возникают м и ц е л л ы-ассоциаты характерного строения, состоящие из десятков дифильных молекул, имеющих длинноцепочечные гидрофобные радикалы и полярные гидрофильные группы.
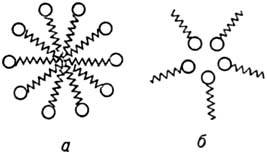
Схематическое изображение ассоциатов ПАВ в воде: а - сферич. прямая мицелла; б-обращенная мицелла.
В т.наз. прямых мицеллах ядро образовано гидрофобными радикалами, а гидрофильные группы ориентированы наружу.
Число молекул ПАВ, образующих мицеллу, наз. числом агрегации; по аналогии с мол. массой мицеллы характеризуются и т. наз. мицелляр-ной массой.
Строение и свойства мицелл ПАВ обусловлены межмолекулярными взаимодействиями между компонентами системы. В случае водных р-ров ионогенных ПАВ устойчивость мицелл определяется равенством сил притяжения неполярных (углеводородных) частей молекул и отталкиванием полярных (ионогенных) групп. Силы притяжения углеводородных частей молекул ПАВ в воде можно отождествить с гидрофобными взаимодействиями, к-рые обусловливают кооперативность мицеллообразования; отталкивание полярных групп приводит к ограничению роста мицелл. Могут быть и др. причины, приводящие к ограничению роста мицелл, такие, как геометрия молекул ПАВ, зависимость поверхностного натяжения на границе раздела мицелла-р-ритель от радиуса мицеллы. В неводных полярных средах (этиленгликоль, глицерин и др.) при мицеллообразовании возникают лиофобные взаи-мод. между углеводородными частями молекул ПАВ, аналогичные гидрофобным.
В сильно неполярных средах полярные группы дифильных молекул становятся лиофобными; в результате формируются мицеллы, в к-рых ядро образовано полярными группами (т. наз. обращенные мицеллы). Числа агрегации в обращенных мицеллах малы по сравнению с числами агрегации в мицеллах, образующихся в водных средах. Агрегация ПАВ в неводных средах резко изменяется в присут. даже следов воды. В последние годы для прямых мицелл предложены новые сферич. модели, среди к-рых наиб. обоснованной представляется модель, полученная на основе изучения малоуглового рассеяния нейтронов мицеллярными р-рами ПАВ. Согласно этой модели, часть мицеллярной пов-сти занята метиленовыми и концевыми метильными группами, к-рые находятся в контакте с водой.
Явление растворения веществ в мицеллах ПАВ называется солюбилизацией. В водных мицеллярных системах солюбилизируются вещества, нерастворимые в воде (бензол, органические красители, жиры). Это обусловлено тем, что ядро мицеллы проявляет свойство неполярной жидкости. В органических мицеллярных раствора, в которых внутренняя часть мицелл состоит из полярных групп, солюбилизируются полярные молекулы воды. Вещество, солюбилизированное раствором ПАВ, называют солюбилизатом, а ПАВ – солюбилизатором.
При солюбилизации неполярных углеводородов в ядрах мицелл углеводородные цепи раздвигаются, в результате размер мицелл увеличивается. Способность коллоидных ПАВ солюбилизировать углеводороды возрастает с ростом концентрации ПАВ. Солюбилизация в водных растворах ПАВ обычно увеличивается с повышением гидрофобности ПАВ и гидрофильности солюбилизата.
Солюбилизация – самопроизвольный и обратимый процесс, в результате которого получаются устойчивые дисперсные системы.
