- •Термодинамическое описание поверхности
- •Поверхностная энергия раздела фаз
- •Способы определения поверхностного натяжения жидкостей
- •Методы определения поверхностного натяжения твердого тела
- •Динамическое поверхностное натяжение
- •Адсорбция полимеров
- •Влияние химического состава и кристаллической структуры твердых тел на свойства поверхности
- •Кислотно-основные свойства поверхности
- •Классификация пав
- •Важнейшие свойства пав
- •4) Точка Крафта
- •Смачивание и растекание жидкости
- •Факторы адгезионного взаимодействия
- •Методы определения адгезионной прочности
- •1.3 Укрывистость
- •1.4 Красящая и разбеливающая способность пигментов
- •1.5 Влияние размера и формы частиц на оптические свойства пигментированного лакокрасочного материала
- •2 Цвет лакокрасочных материалов и его расчет
- •2.1. Механизм зрения
- •2.1.1 Цветовое зрение
- •2.1.2 Нарушение цветового зрения
- •2.2 Источники света. Цветовая температура
- •2.3 Природа цвета
- •2.4 Аддитивное и субтрактивное смешение цветов
- •2.5 Метрология цвета
- •2.5.1 Основные понятия и определения
- •2.5.2 Неравноконтрастные колористичекие системы
- •2.5.2.1 Система r, g,в
- •6.2.2 Колористическая система xyz
- •2.5.3 Колористическая система ciel*a*b*
- •2.5.4 Метамеризм
- •2.6 Расчет цветовых характеристик. Метод взвешенных и избранных ординат
- •2.6.1 Геометрия измерения
- •2.6.2 Аппаратура
- •2.6.3 Расчет координат цвета по способу взвешенных ординат
- •2.6.3 Расчет координат цвета по способу избранных ординат
- •2.6.4 Расчет цветового различия
- •2.6.4 Оценка белизны
- •2.6.5 Оценка желтизны
- •2.6.6 Оценка черноты
- •Задачи для самостоятельной подготовки студентов
- •Оптические свойства наполненных полимерных систем
- •Системы спецификаций
- •Атлас ncs
- •Диэлектрическая проницаемость
- •Электрическая прочность
- •Регулирование теплофизических свойств полимерных материалов
- •Учебники
- •Учебные пособия, учебные практикумы, справочники
Термодинамическое описание поверхности
В лакокрасочном покрытии в непрерывную фазу пленкообразователей - включены в виде дисперсной фазы отдельные частицы и агрегаты пигментов и наполнителей. Т.е. лакокрасочные материалы и композиционные лакокрасочные покрытия являются гетерогенными системами, и характеризуются наличием различных поверхностей раздела фаз.
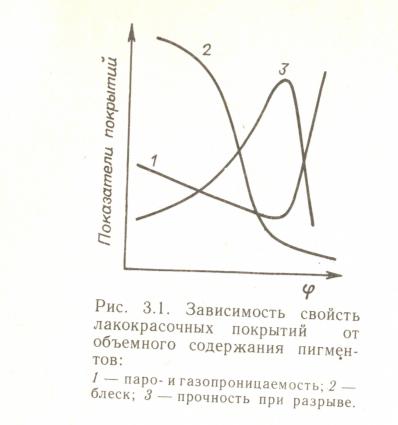
Степень наполнения определяет такие свойства материала как устойчивость при хранении, степень структурирования, реология, влияет на твердость, проницаемость, блеск, укрывистость. О наполнении судят по выраженному в процентах объемному содержанию пигментов (ОКП).
(Говорить объемная концентрация пигментов (ОКП) неправильно, так как количество твердой фазы - это лишь среднестатистическое содержание ее в общем объеме пленки, а не концентрация).
ОКП определяют по следующей формуле:
φ = Vпигмента/(Vпигмента + Vсвязующего),
где Vпигмента, Vсвязующего- соответственно объем пигмента и связующего.
Vпигмента = м/ρ
При увеличении ОКП происходит снижение доли пленкообразователя, снижение толщины межфазных прослоек, вплоть до полного соприкосновения частиц с нарушения непрерывности среды пленкообразователя. Область перехода структуры наполненного полимерного покрытия называют критическим объемным содержанием пигмента (КОКП) φкр. В области перехода структур резко изменяются реологические свойства лакокрасочных материалов (например, их текучесть) блеск, механические и защитные свойства покрытий. |
|
Поверхностная энергия раздела фаз
Появление избыточной энергии на поверхности раздела фаз связано с некомпенсированостью межатомного, межмолекулярного взаимодействия в твердых и жидких поверхностях.
Избыток энергии на поверхности проявляется в появлении поверхностного натяжения.
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ, стремление в-ва (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию). Определяется как работа, затрачиваемая на создание единицы площади пов-сти раздела фаз (размерность Дж/м2). Согласно др. определению, поверхностное натяжение-сила, отнесенная к единице длины контура, ограничивающего пов-сть раздела фаз (размерность Н/м); эта сила действует тангенциально к пов-сти и препятствует ее самопроизвольному увеличению.
Единица его измерения в системе СИ: 1Н/м (ньтонах на метр = 1 Дж/м2, или миллиньтонах на метр.
Поверхностное натяжение имеет двойной физический смысл — энергетический (термодинамический) и силовой (механический). Энергетическое (термодинамическое) определение: поверхностное натяжение — это удельная работа увеличения поверхности при её растяжении при условии постоянства температуры. Силовое (механическое) определение: поверхностное натяжение — это сила, действующая на единицу длины линии, которая ограничивает поверхность жидкости.
По поверхностному натяжению пластовых жидкостей на различных поверхностях раздела можно судить о свойствах соприкасающихся фаз, закономерностях взаимодействия жидких и твёрдых тел, процессах адсорбции, количественном и качественном составе полярных компонентов в жидкости, интенсивности проявления капиллярных сил и т.д.
Прибор для измерения поверхностного натяжения называется тензиометр.
Энергетическое состояние любой системы и возможность протекания тех или иных процессов описывается термодинамическими потенциалами.
Соответствующие дифференциалы термодинамических потенциалов:
для внутренней энергии
![]() ,
,
для энтальпии
![]() ,
,
для свободной энергии Гельмгольца
![]() ,
,
для потенциала Гиббса
![]() .
.
Эти выражения математически можно рассматривать как полные дифференциалы функций двух соответствующих независимых переменных. Поэтому естественно рассматривать термодинамические потенциалы как функции:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Хими́ческий потенциа́л μ — один из термодинамических параметров системы, а именно энергия добавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде:
![]()
где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
Эта формула определяет, кроме химического потенциала μ, также давление P и температуру T.
Можно доказать, что химический потенциал задаётся формулой
![]() ,
,
где G — потенциал Гиббса
Для поверхности раздела фаз функцию химического потенциала выполняет поверхностное натяжение.