
- •06 Сентября 2012 г.
- •Кафедра теплотехники и теплосиловых установок сПбГлту
- •Введение
- •Расчет характеристик и процессов для газовой смеси
- •1. Задание на курсовую работу
- •1.1. Расчет характеристик газовой смеси
- •1.2. Расчет теплоемкостей газовой смеси
- •1.3. Расчет термодинамического цикла
- •Исходные данные к курсовой работе
- •Исходные данные к курсовой работе
- •Параметры состояния рабочего тела в характерных точках цикла
- •Результаты расчетов характеристик процессов цикла
- •2. Указания по выполнению курсовой работы
- •2.1. Расчет характеристик газовой смеси
- •Соотношение для расчета смесей идеальных газов
- •2.2. Расчет теплоемкостей газовой смеси
- •2.3. Расчет термодинамического цикла
- •Формулы для расчета термодинамических процессов
- •Зависимость термического кпд от степени сжатия
- •Зависимость термического кпд от степени повышения давления
- •Библиографический список
- •Молярные массы, плотности и газовые постоянные важнейших газов
- •Образец оформления титульного листа
- •А. Указания по оформлению курсовой работы
- •Б. Правила оформление расчетов
- •2. Графическое представление физических величин.
- •1 94021, Санкт-Петербург, Институтский пер., 5.
2.2. Расчет теплоемкостей газовой смеси
2.2.1.
Средняя массовая изобарная теплоемкость
смеси
![]() в интервале температур
от 0 и t,
оС,
рассчитывается по
формуле:
в интервале температур
от 0 и t,
оС,
рассчитывается по
формуле:
![]() ,
кДж / (кг · К); (8)
,
кДж / (кг · К); (8)
где
gi
– массовая доля i-го
компонента заданной газовой смеси, по
данным расчета;
![]() –
средняя массовая изобарная теплоемкость
i-го
компонента в интервале температур от
0 до t,
оС
(определяется по
прил.
3), кДж
/ (кг · К).
–
средняя массовая изобарная теплоемкость
i-го
компонента в интервале температур от
0 до t,
оС
(определяется по
прил.
3), кДж
/ (кг · К).
2.2.2.
Средняя массовая изобарная теплоемкость
смеси
![]() в интервале
температур от t1
до t2,
оС,
рассчитывается по формуле:
в интервале
температур от t1
до t2,
оС,
рассчитывается по формуле:
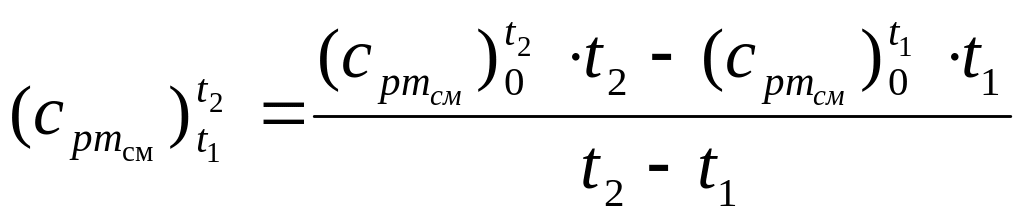 ,
кДж / (кг ·
К).(9)
,
кДж / (кг ·
К).(9)
Входящие
в (9) величины
![]() и
и
![]() рассчитываются
по формуле (8).
рассчитываются
по формуле (8).
2.2.3.
Средняя массовая теплоемкость смеси
при υ
= const
![]() может быть рассчитан по формуле Майера,
которая для рассматриваемого случая
принимает вид:
может быть рассчитан по формуле Майера,
которая для рассматриваемого случая
принимает вид:
![]() ,
кДж / (кг ·
К). (10)
,
кДж / (кг ·
К). (10)
или
![]() ,
кДж / (кг · К). (11)
,
кДж / (кг · К). (11)
2.2.4. По определению показателя адиабаты вычисляется его значение по соотношению:
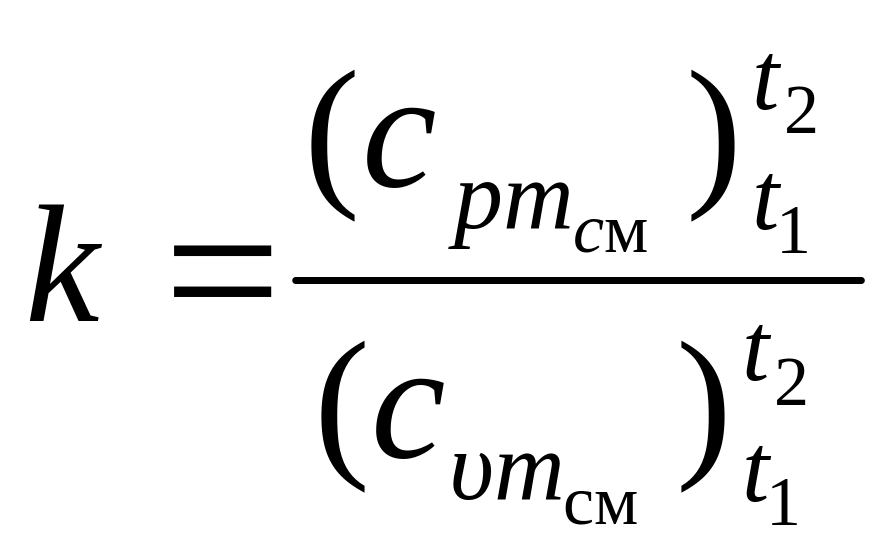 . (12)
. (12)
2.2.5. В соответствии с законами идеальных газов массовые, объемные и мольные теплоемкости связаны между собой определенными соотношениями:
 кДж
/ (нм3
· К) (13)
кДж
/ (нм3
· К) (13)
или
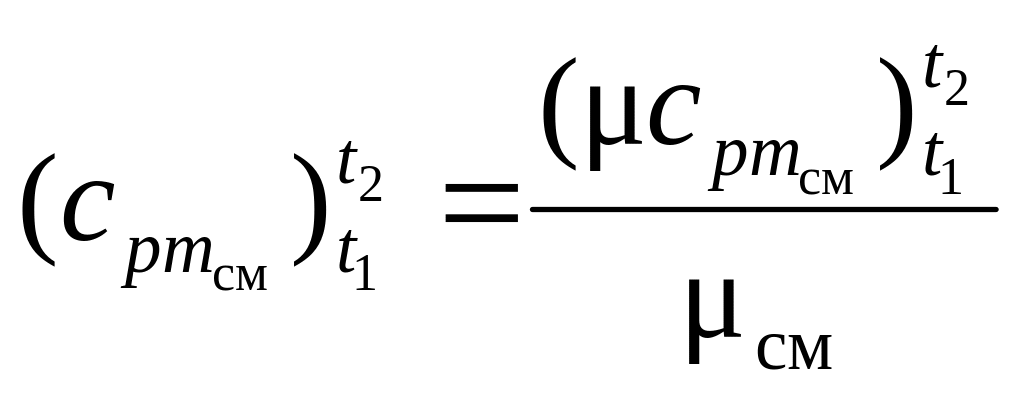 ,
кДж / (кг · К), (14)
,
кДж / (кг · К), (14)
где μс – мольная теплоемкость, Дж / (моль ∙ К); μ – молярная масса вещества, кг / моль; 22,4 – объем 1 кмоля при нормальных условиях, нм3 / моль.
Из (13) и (14) при найденной средней молярной массе смеси μсм и средней массовой теплоемкости смеси выражаются средняя объемная и мольная теплоемкости заданной газовой смеси.
Аналогично рассчитываются объемные и мольные теплоемкости смеси при υ = const по известным μсм и .
2.2.6. Абсолютные значения теплоты рассчитываются по формулам:
![]() ,
кДж (15)
,
кДж (15)
![]() ,
кДж (16)
,
кДж (16)
![]() ,
Дж (17)
,
Дж (17)
где М, V, N – масса (кг), объем (нм3), число молей (моль) нагреваемой (охлаждаемой) газовой смеси соответственно, табл. 1; QM, QV, QN - теплоты, получаемые (отдаваемые) газовой смесью, имеющей массу М, объем V и число молей N.
2.3. Расчет термодинамического цикла
2.3.1. Расчет цикла начинается с нахождения параметров любой точки, для которой известны 2 параметра, третий – находится по уравнению Клапейрона для 1 кг газовой смеси:
p υ = R T, (18)
где р – давление, Па; υ – удельный объем, м3 / кг; R – газовая постоянная, Дж / (кг · К); Т – температура, К.
2.3.2. Затем рассчитываются недостающие параметры для остальных точек. Для этого используются соотношение между основными параметрами для каждого процесса (табл. 6), уравнение Клапейрона (18) и характеристики цикла ε, λ и ρ (табл.2).
Примечание: При расчете адиабатного процессе принимать показатель адиабаты k, вычисленный по (12).
2.3.3. Найденные значения р, υ, Т заносятся в табл. 3. На основании этих данных строится цикл в координатах р – υ (с соблюдением масштаба, прил. 6). В подрисуночной надписи приводятся названия каждого изображенного термодинамического процесса.
2.3.4. Подведенная (в процессах 2 – 3 и 3 – 4) или отведенная теплота (в процессе 5 – 1), работа изменения объема газовой смеси, изменения внутренней энергии и энтальпии, изменение энтропии в зависимости от вида процесса рассчитываются по формулам табл. 6.
2.3.5. Используя результаты расчетов, заполняется табл. 4.
2.3.6. Эффективность работы цикла определяется путем нахождения его термического КПД (ηt) по формуле
![]() ,
(19)
,
(19)
где lц – работа цикла, Дж / кг; q1 и q2 – соответственно подведенная и отведенная теплота, Дж / кг.
2.3.7. Термический КПД, вычисленный по (19) зависит характеристик: степени сжатия ε, степени повышения давления λ и степени предварительного расширения ρ (табл. 2).
Рассмотрим,
как выводится эта зависимость [1]. Будем
считать, что теплоемкость рабочего тела
с,
кДж / (кг · К), имеет некоторое среднее
значение и не изменяется во время цикла.
Для нашего случая, эти теплоемкости
можно обозначить
![]() = const
и
= const
и
![]() = const
(это средние удельные теплоемкости
смеси при р
= const
и υ
= const
соответственно).
= const
(это средние удельные теплоемкости
смеси при р
= const
и υ
= const
соответственно).
Т аблица
6
аблица
6
