
- •Экзаменационные вопросы по курсу Физика.
- •Системы отсчета. Инерциальные системы отсчета.
- •Преобразования Галилея. Принцип относительности Галилея.
- •Постулаты Эйнштейна.
- •Преобразования Лоренца (прямые и обратные).
- •Равенство поперечных размеров тела.
- •Сокращение продольных размеров тела.
- •Явление замедления времени.
- •Понятие одновременности событий.
- •Релятивистский интервал, его инвариантность.
- •Преобразования скоростей.
- •Модуль идеального газа. Молекулярно-кинетическая трактовка температуры.
- •Явление переноса в газах.
- •Число столкновений молекул.
- •Длина свободного пробега молекул.
- •Диффузия газов. Коэффициент диффузии.
- •Вязкость газа (внутренне трение). Коэффициент вязкости.
- •Теплопроводность газа. Коэффициент теплопроводности.
Модуль идеального газа. Молекулярно-кинетическая трактовка температуры.
Рассмотрим некоторую массу разряженного газа:
Размеры молекул малы по сравнению с r между молекулами. V очень мал по сравнению с размерами сосуда.
Fприт. Очень малы.
Газ, который подчиняется этим условиям, можно назвать идеальным.
Молекулярно-кинетическая трактовка температуры:
Температура - это мера погрешности тела. T~2/3*(m*V^2)/2, где T-температура в Кельвинах.k-коэффициент Больцмана (k=1.38*10^-23 Дж/град)=> T= 2/3*1/k*(m*v^2/2)
Молекулярно-кинетическая трактовка давления.
Давление - это сила, с которой молекулы газа действуют на тело(1 площади). P=2/3*n*(m*V^2/2) P=F/√s
Основное уравнение молекулярно-кинетической теории газа.
p=2/3*n*(m*V^2/2) n=N/V
p=2/3*N/V*(m*V^2/2)=>p*V=2/3*(m*V^2/2)*N, где 2/3*(m*V^2/2)=k*T=>p=n*k*T
Уравнение состояния газа для произвольной массы p*V=N*k*T, N=Na*V, где Na= 6*10^-23(количество молекул в 1 моль вещества). V=m/M
p*V=m/M*R*T=V*R*T
p= Rуд*ῤ*T
Скорости газовых молекул.
Eкин=(mₒ*Vˉ)/2=2/3*k*T=>Vˉкв=((√3*k*T)/mₒ)
mₒ*Na=ϻ=>mₒ=ϻ/Na
Vˉкв=√3*k*T*Na/ϻ k*Na=R=> Vˉкв=√3*R*T*/ϻ
Распределение Максвелла, зависимость от рода газа, температуры.
В результате теплового хаотического движения молекул происходит их разделение по скоростям.
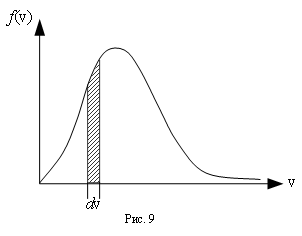 Vв=√2*R*T*/mₒ
=√2*R*T*/ϻ;
Vср=√8*R*T*/π*mₒ
=√2*R*T*/π*ϻ
Vв=√2*R*T*/mₒ
=√2*R*T*/ϻ;
Vср=√8*R*T*/π*mₒ
=√2*R*T*/π*ϻ
Распределение Больцмана, зависимость от рода газа, температуры.
Атмосферный воздух состоит из молекул газа и претерпевает хаотическому движению. Распределение количества молекул зависит от высоты.
p(h)=pₒ*e^-((mₒ*g*h)/(R*T)), где (mₒ*g*h)-Eпотенциальная и (R*T)-Eкинетическая
p(h)=pₒ*e^-(( ϻ* g*h)/(R*T))
p=n*k*T=(N/V)*(k*T)
n(h)*k*T=nₒ*k*T* e^-((mₒ*g*h)/(k*T))
n(h) =nₒ * e^-((mₒ*g*h)/(k*T)) (e=2,7)
N(n)=Nₒ* e^-((mₒ*g*h)/(k*T))
ῤ=ῤ/ϻ*R*T
ῤ=ῤ*e^-((mₒ*g*h)/(k*T))
Явление переноса в газах.
Если система выведена из равновесного состояния, то она через некоторое время стремится вернуться в то состояние за счет переноса молекул из одной точки в другую.
Диффузия - это выравнивание концентрации
Теплопроводность – это перенос молекул из одной точки в другую, но с разными скоростями
Вязкость – это внутреннее трение или сопротивление течению жидкости.
Число столкновений молекул.
За счет теплопроводности хаотического движения молекула движется непрямолинейно.
hˉ=hi/z z=1/2*π*d^2*Vотн*n^2
h=(√2*(π*d^2*n)). π*d^2-σ
Vотн= √2*Vˉ
Z=√2/2*π*d^2*n^2*Vˉ=√2/2*σ*n^2*Vˉ
Длина свободного пробега молекул.
Диффузия газов. Коэффициент диффузии.
Пусть в газе присутствует посторонняя примесь концентрации n. В разных m и V концентрация различна. В точке с координатой х концентрация n. ̻n/̻x-градиент концентрации. Если градиент не равен 0, то из-за хаотического движения молекул система стремится к равновесию (n/̻x>>c)
̻N+ = 1/6*n1*Vˉ*̻s*̻t, где 1/6- вероятностный коэффициент.
̻N- = 1/6*n2*Vˉ*̻s*̻t
̻N= ̻N+ - ̻N- , где ̻N- суммарный диффузный поток
j=̻N/(̻s*̻t)= 1/6*Vˉ*(n1-n2)= -h1/6*Vˉ*(n2-n1)=> j = 1/3*h*Vˉ*grad n
D= 1/3*h*Vˉ
j= -D* grad n «-» - показывает на то, что диффузный поток направлен противоположно градиенту концентрации.
Коэффициент диффузии – количество молекул, которое проходит в единицу времени ̻t через единичную площадь ̻s при grad n=1.
