
- •1. Предмет технической термодинамики. Рабочее тело.
- •2. Определение параметров воды и пара.
- •3. Удельный расход пара и теплоты в паротрубных установках.
- •1. Основные термодинамические параметры состояния.
- •2. Термодинамические процессы реальных газов.
- •3. Принципиальные схемы паротрубных установок
- •3. Циклы газотрубных установок.
- •1. Внутренняя энергия рабочего тела.
- •2. Определение скорости истечения при адиабатном процессе.
- •3. Обратный цикл Карно.
- •1. Первый закон термодинамики.
- •2. Истечение капельной жидкости.
1. Первый закон термодинамики.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
|
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
|
2. Истечение капельной жидкости.

3. Основные понятия о работе холодильных установок.


ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 8
1. Энтальпия газа.
С точки зрения молекулярно-кинетической теории внутренняя энергия составляется из кинетической энергии всех частиц (молекул, атомов), потенциальной энергии взаимодействия молекул и энергии колебательного движения атомов (т. н. нулевой энергии). Внутренняя энергия есть функция состояния, зависящая от температуры и давления, а для идеального газа — только от температуры (в этом случае потенциальной энергией взаимодействия пренебрегают). На практике значение имеет не сама величина внутренней энергии, и ее изменение ΔU: ΔU = cVM (t2 – t1) (2.62) где сVM — средняя удельная массовая теплоемкость при постоянном объеме в пределах от t1 до t2, кДж/(кг•°С). Таким образом, изменение внутренней энергии идеального газа равно произведению средней теплоемкости при постоянном объеме на разность температур газа.
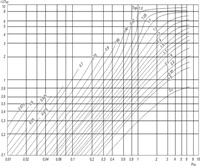
Рис. 2.10. Зависимость энтальпии газов от приведенных температуры и давления.
Единицы удельной внутренней энергии — джоуль на килограмм (Дж/кг), джоуль на киломоль (Дж/кмоль) и джоуль на метр кубический (Дж/м3). Энтальпия (теплосодержание насыщенного газа) — количество теплоты, необходимое для повышения температуры 1 кг вещества от абсолютного нуля до пара заданной температуры. В общем случае энтальпия является функцией температуры и давления. Как и в случае с внутренней энергией, чаще надо знать изменение энтальпии ΔI, а не ее абсолютное значение: ΔI = срМ (t2 – t1) (2.63) где срМ — средняя удельная массовая темплоемкость при постоянном давлении в пределах от t1 до t2, кДж/(кг.°С). Следовательно, изменение энтальпии идеального газа равно произведению средней теплоемкости при постоянном давлении на разность температур газа. Энтальпию реального газа можно рассматривать как сумму энтальпии в идеальном состоянии и соответствующего корректирующего члена: I = Iид + ΔI (2.64)
2. Основные условия истечения газа по каналам переменного сечения.
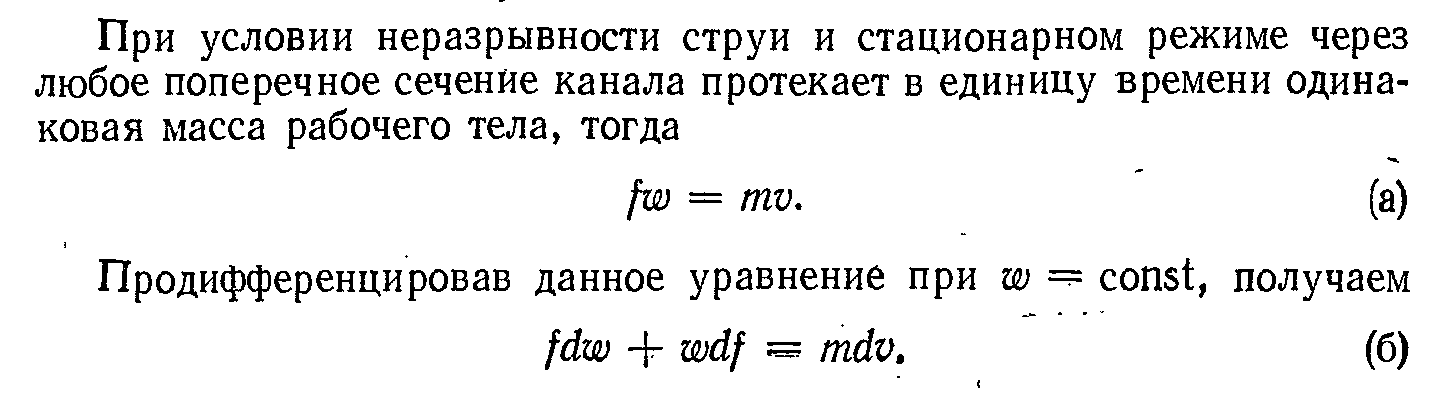

3. Циклы воздушных холодильных установок.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 9
1. Энтропия.
Энтропия, так же как энтальпия и внутренняя энергия, — функция состояния рабочего тела (системы). Элементарное приращение энтропии в любом обратимом процессе выражается соотношением dS = dQ/T = (dU + Adl)/T (2.65) где dS — приращение энтропии, кДж/(кг•К); dQ — изменение тепловой энергии рабочего тела, кДж/кг; dU — приращение внутренней энергии, кДж/кг; dl — внешняя работа, кДж/кг; А—тепловой эквивалент работы, равный 1/101,7 кДж (кг•м); Т — абсолютная температура, К.
2. Истечение газа с учетом трения.

3. Абсорбционные холодильные установки

ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 10
1. Изохорный процесс.
Изохорный процесс -это процесс, происходящий в физической системе при постоянном объёме (V = const). Так как V = const, то dV =0, а следовательно, и dA = pdV = 0.
Вся теплота, сообщенная газу при изохорном процессе, идет на увеличение его внутренней энергии.
Изохорный процесс :
dQ = dU
CvdT = dU
(Cv - молярная теплоемкость газа при постоянном объеме)

График изохорного процесса
2. Определение скорости истечения при адиабатном процессе.


3. Пароэжекторные холодильные установки.


ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ №11
1. Изобарный процесс.
Изобарный процесс -это процесс, происходящий в физической системе при постоянном давлении (p = const). При этом изменяются объем и температура, следовательно, совершается работа dA = pdV и изменяется внутренняя энергия dU.
Изобарный процесс :
dQ = dU+pdV
При изобарном процессе dQp = CpdT, поэтому первое начало термодинамики примет вид:
CpdT = CvdT + pdV
Уравнение состояния для моля идеального газа:
pV = RT
Для изобарного процесса это уравнение примет вид
pdV = RdT
Соотношения Cp = Cv+R или Cp-Cv = R называют уравнением Майера.
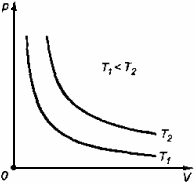
График изобарного процесса
2. Истечение газов и паров.
Истечением называют процесс выхода сжатого до р1 газа или пара через сопло в среду с меньшим давлением р2. Сопло представляет собой канал, образованный жесткими стенками. Сопло может иметь постоянное сечение, суживающееся или комбинированное. Основная задача данного раздела заключается в том, чтобы обеспечить падение давления р1 к выходу из сопла до р2. В этом случае вся потенциальная энергия, соответствующая разнице (р1–р2), полностью превращается в кинетическую энергию струи, вылетающей из сопла. Это значит, что струя получает максимально возможную скорость при данном перепаде давлений (р1–р2) и, падая на объект, совершает максимальную работу.
Рис. 7.1. Истечение |
Выбор формы сопла зависит от величины отношения р2/р1 = (рис. 7.1). При р2 = р1 = 1 – истечение не происходит. При увеличении р1 и р2 = const уменьшается, а расход газа М и скорость истечения С увеличиваются по кривой 1–2. При некотором значении = КР расход достигает максимального значения Мmax, а скорость критической величины СКР, м/с. Если сопло будет иметь постоянное сечение 1 или суживающееся 2, то при дальнейшем увеличении р1 и соответствующем уменьшении b, расход останется равным Мmax, а скорость постоянной и равной СКР. При этом давление р1 падает к выходу из сопла только до рКР, которое значительно выше давления окружающей среды р2. |
3. Цикл Ренкина.

ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 12
1. Изотермический процесс
Изотермический процесс -это процесс, происходящий в физической системе при постоянной температуре (T = const).
При постоянной температуре dU =0, поэтому все сообщаемое системе количество теплоты расходуется на совершение работы против внешних сил.
Изотермический процесс :
dQ = dA
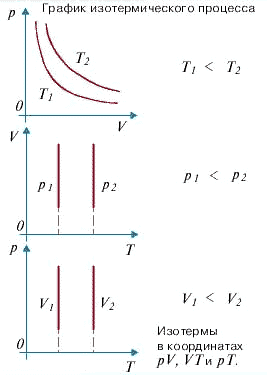
График изотермического процесса
2. i.s диаграмма водного пара.
h, s-диаграмма водяного пара. Если за независимые параметры, определяющие состояние рабочего тела, принять энтропию s и энтальпию h, то каждое состояние можно изобразить точкой на h, s-диаграмме.
На рисунке 6.3 изображена h, s-диаграмма для водяного пара, которая строится путем переноса числовых данных таблиц водяного пара в h, s-координаты.
За начало координат принято состояние воды в тройной точке. Откладывая на диаграмме для различных давлений значения s' и h'' для воды при температуре, кипения, а также s" и h" для сухого насыщенного пара, получаем нижнюю и верхнюю пограничные кривые.
Рисунок 6.3 - h, s-диаграмма водяного пара
Изобары в двухфазной области влажного пара представляют собой пучок расходящихся прямых. Действительно, в процессе р=const , или , т.е. тангенс угла наклона изобары в h, s-координатах численно равен абсолютной температуре данного состояния. Так как в области насыщения изобара совпадает с изотермой, тангенс угла наклона постоянен и изобара является прямой. Чем выше давление насыщения, тем выше температура, тем больше тангенс угла наклона изобары, поэтому в области насыщения прямые р = const расходятся. Чем больше давление, тем выше лежит изобара. Критическая точка К лежит не на вершине, как это было в р, v- и Т, s-диаграммах, а на левом склоне пограничной кривой.
В области перегрева температура пара (при постоянном давлении) растет с увеличением s примерно по логарифмической кривой и крутизна изобары увеличивается. Аналогичный характер имеют изобары и в области воды, но они идут так близко от пограничной кривой, что практически сливаются с ней.
При низких давлениях и относительно высоких температурах перегретый пар по своим свойствам близок к идеальному газу. Так как в изотермическом процессе энтальпия идеального газа не изменяется, изотермы сильно перегретого пара идут горизонтально. При приближение к области насыщения, т. е. к верхней пограничной кривой, свойства перегретого пара значительно отклоняются от свойств идеального газа и изотермы искривляются.
В h, s-диаграмме водяного пара нанесены также линии v=const, идущие круче изобар.
Обычно всю диаграмму не выполняют, а строят только ее верхнюю часть, наиболее употребительную в практике расчетов. Это дает возможность изображать ее в более крупном масштабе.
Для любой точки на этой диаграмме можно найти р, v, t, h, s, x. Большое достоинство диаграммы состоит в том, что количество теплоты в изобарном процессе равно разности ординат конечной и начальной точек процесса и изображается отрезком вертикальной прямой, а не площадью как в Т, s-диаграмме, поэтому h, s-диаграмма исключительно широко используется при проведении тепловых расчетов.
3. Термический КПД цикла Ренкина и способы его повышения.



ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 13
1. Адиабатный процесс.
Адиабатный процесс - это процесс, протекающий без теплообмена с окружающей средой.
Адиабатными можно считать быстро протекающие процессы. При быстром сжатии газа затрачивается работа, приводящая к увеличению внутренней энергии и повышению температуры. Тело, температура которого повышена, должно некоторое количество теплоты передать окружающей среде, но процесс теплопередачи требует некоторого времени, поэтому при быстром сжатии (или расширении) теплота не успевает распространиться из данного объема, то есть dQ = 0, и процесс можно рассматривать как адиабатный.
Адиабатный процесс (первое начало термодинамики):
dA = -dU.
Адиабатный процесс
2. Термодинамические процессы реальных газов.
1. Изохорный процесс.
Изохорный процесс - процесс, происходящий при постоянном объеме
Давление газа пропорционально его температуре.
Вся подведенная теплота расходуется на изменение внутренней энергии рабочего тела
2. Изобарный процесс - процесс, происходящий при постоянном давлении.
Удельный объем газа пропорционален его температуре
Вся подведенная теплота расходуется на изменение энтальпии рабочего тела
Работа процесса равна произведению давления на изменение объема.
Следовательно, касательная, проведенная к кривой процесса в TS - координатах, отсекает на оси S отрезок, численно равный изобаррной теплоемкости Ср.
3. Изотермический процесс.
Изотермический процесс - процесс, происходящий при постоянной температуре.
4. Адиабатический (изоэнтропный) процесс.
Адиабатный процесс - процесс, совершающийся при отсутствии теплообмена рабочего тела с окружающей средой.
5. Политропный процесс.
Политропный процесс - процесс, в котором изменяются все параметры состояния, а теплоемкость остается постоянной.
3. Воздушная холодильная установка.
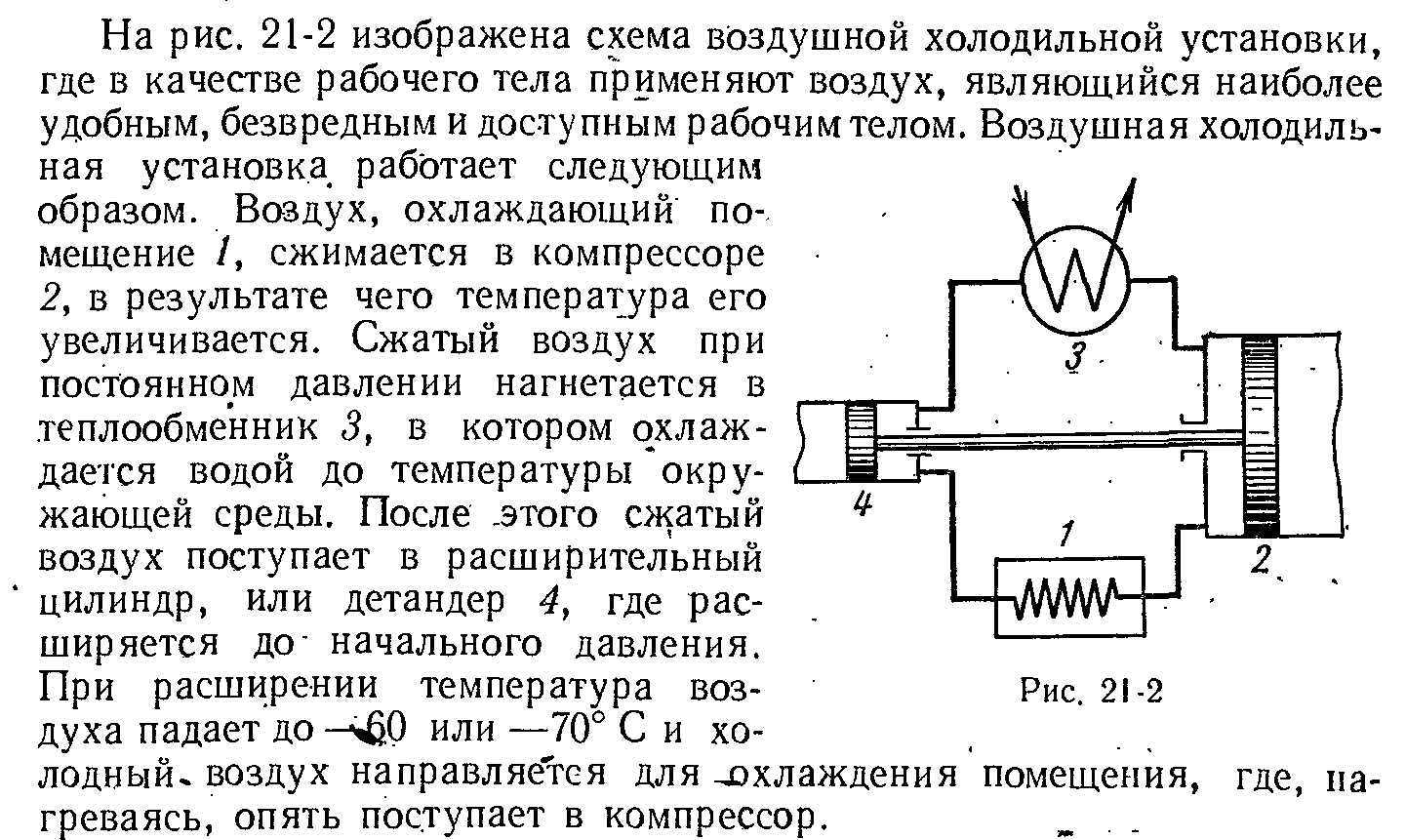
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 14
1. Политропный процесс.
Политропный процесс это процесс, в котором теплоемкость остается постоянной. Политропным процессом являются изохорный, изобарный, изотермический и адиабатный процессы, потому что все они имеют общую особенность - они происходят при постоянной теплоемкости.
В первых двух процессах теплоемкости соответственно равны Cv и Cp, в изотермическом процессе (dT=0) теплоемкость равна бесконечности, в адиабатном политропный процесс равна нулю. График политропного процесса показан ниже:

График политропного процесса
Политропа
Политропа
это график зависимости между параметрами
состояния идеального газа при
![]() .
Политропа в координатах p, V - гипербола,
занимающая промежуточное положение
между изотермой и адиабатой.
.
Политропа в координатах p, V - гипербола,
занимающая промежуточное положение
между изотермой и адиабатой.
Исходя из первого начала термодинамики при условии постоянства теплоемкости ( ), можно вывести уравнение политропы:
![]() -
уравнение
политропы,
-
уравнение
политропы,
где
![]() -
показатель политропы.
-
показатель политропы.
2. Истечение капельной жидкости.
3. Применение регенерации в газотрубных установках
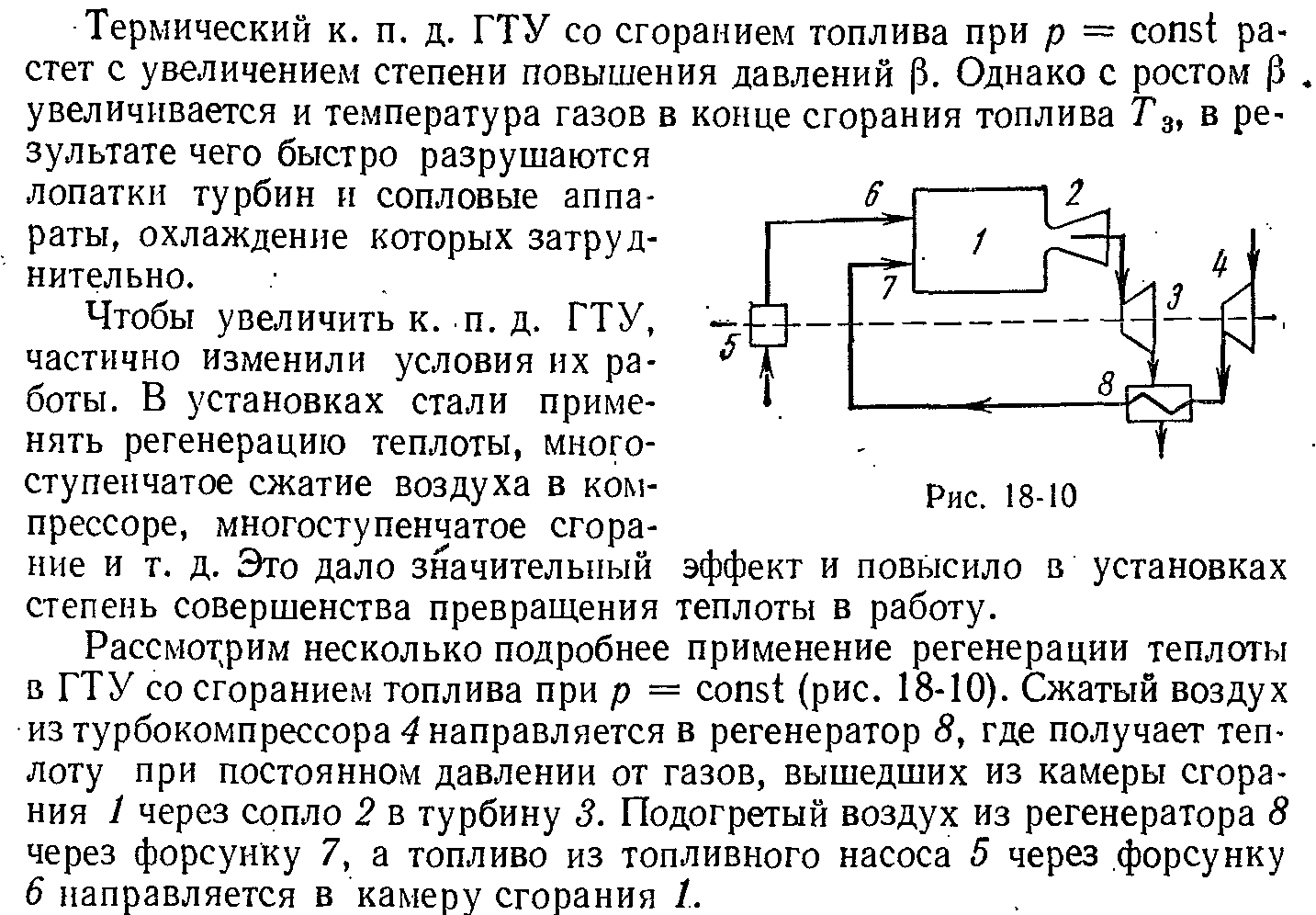
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 15
1. Круговой процесс.
Круговым процессом (или циклом) называется процесс, при котором система, проходя через ряд состояний, возвращается в первоначальное. На диаграмме цикл изображается замкнутой кривой (рис. 1). Цикл, который совершает идеальный газ, можно разбить на процессы расширения (1—2) и сжатия (2—1) газа. Работа расширения (равна площади фигуры 1a2V2V11) положительна (dV>0), работа сжатия (равна площади фигуры 2b1V1V22) отрицательна (dV<0). Следовательно, работа, которую совершает газ за цикл, равен площади, охватываемой замкнутой кривой. Если за цикл совершается положительная работа A=∫pdV>0 (цикл идет по часовой стрелке), то он называется прямым (рис. 1, а), если за цикл осуществляется отрицательная работа A=∫pdV<0 (цикл идет против часовой стрелки), то он называется обратным (рис. 1, б).
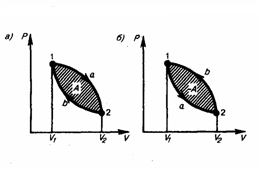
Рис.1
Прямой
цикл применяется в тепловых
двигателях
— периодически действующих двигателях,
которые совершают работу за счет
полученной извне теплоты. Обратный цикл
применяется в холодильных
машинах
— периодически действующих установках,
в которых за счет работы внешних сил
теплота переходит к телу с более высокой
температурой.
В результате
кругового процесса система возвращается
в исходное состояние и, значит, полное
изменение внутренней энергии газа есть
нуль. Поэтому первое
начало термодинамики для кругового
процесса
![]() (1)
т. е. работа, которая совершается
за цикл, равна количеству теплоты,
полученной извне. Однако в результате
кругового процесса система может теплоту
как получать, так и отдавать, поэтому
(1)
т. е. работа, которая совершается
за цикл, равна количеству теплоты,
полученной извне. Однако в результате
кругового процесса система может теплоту
как получать, так и отдавать, поэтому
![]() где
Q1
— количество теплоты, которая получила
система, Q2
— количество теплоты, которое отдала
система. Поэтому термический
коэффициент полезного действия для
кругового процесса
где
Q1
— количество теплоты, которая получила
система, Q2
— количество теплоты, которое отдала
система. Поэтому термический
коэффициент полезного действия для
кругового процесса
![]() (2)
Термодинамический процесс
называется обратимым,
если он может осуществляться как в
прямом, так и в обратном направлении,
причем если такой процесс осуществляется
сначала в прямом, а затем в обратном
направлении и система возвращается в
первоначальное состояние, то в окружающей
среда и в этой системе не происходит
никаких изменений. Всякий процесс, не
удовлетворяющий этим условиям, является
необратимым.
(2)
Термодинамический процесс
называется обратимым,
если он может осуществляться как в
прямом, так и в обратном направлении,
причем если такой процесс осуществляется
сначала в прямом, а затем в обратном
направлении и система возвращается в
первоначальное состояние, то в окружающей
среда и в этой системе не происходит
никаких изменений. Всякий процесс, не
удовлетворяющий этим условиям, является
необратимым.
2. Работа проталкивания.

3. КПД холодильных машин.
Коэффициент
полезного действия или холодильный
коэффициент холодильной машины можно
определить как отношение отнятой от
охлаждаемого тела теплоты
![]() к
затраченной для этого механической
работе
к
затраченной для этого механической
работе
![]() :
:
|
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 16
1. Цикл Карно и его термодинамическое значение.
2. Критическая скорость истечения газа из насадки.
![]()

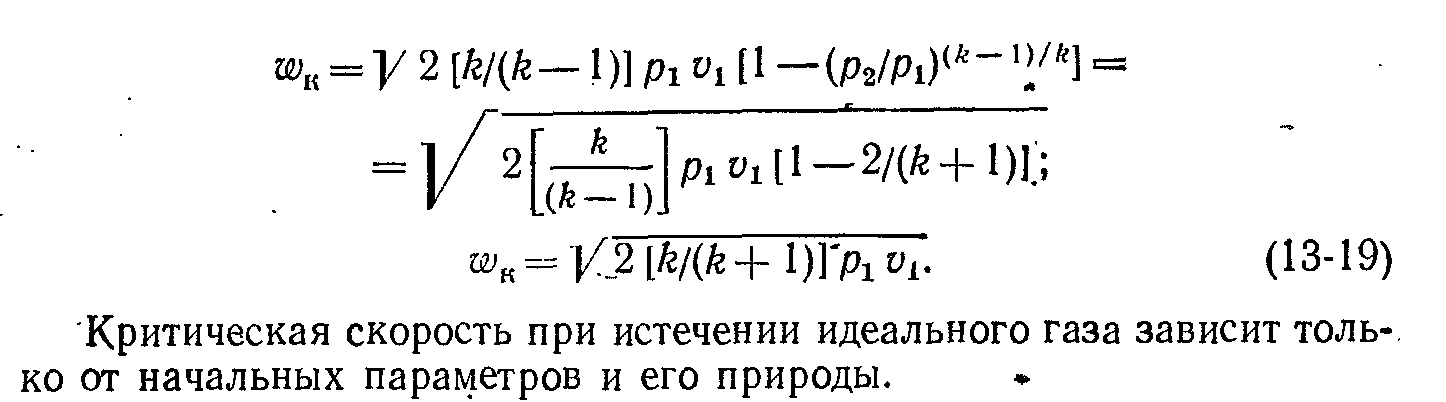
3. Недостаток цикла Карно в паросиловых установках.

ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 17
1. Второй закон термодинамики. Принцип возрастания энтропии.



2. Основные термодинамические процессы водяного пара.

3. Условия равновесия фаз.


ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 18
1. Изменение энтропии в неравновесных процессах.
2. Максимальный расход газа через насадку.
![]()

3. Химическое равновесие и потенциал.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 19
1. Дросселирование газов и паров.

2. Тепловой насос.

![]()
3. Циклы поршневых двигателей.

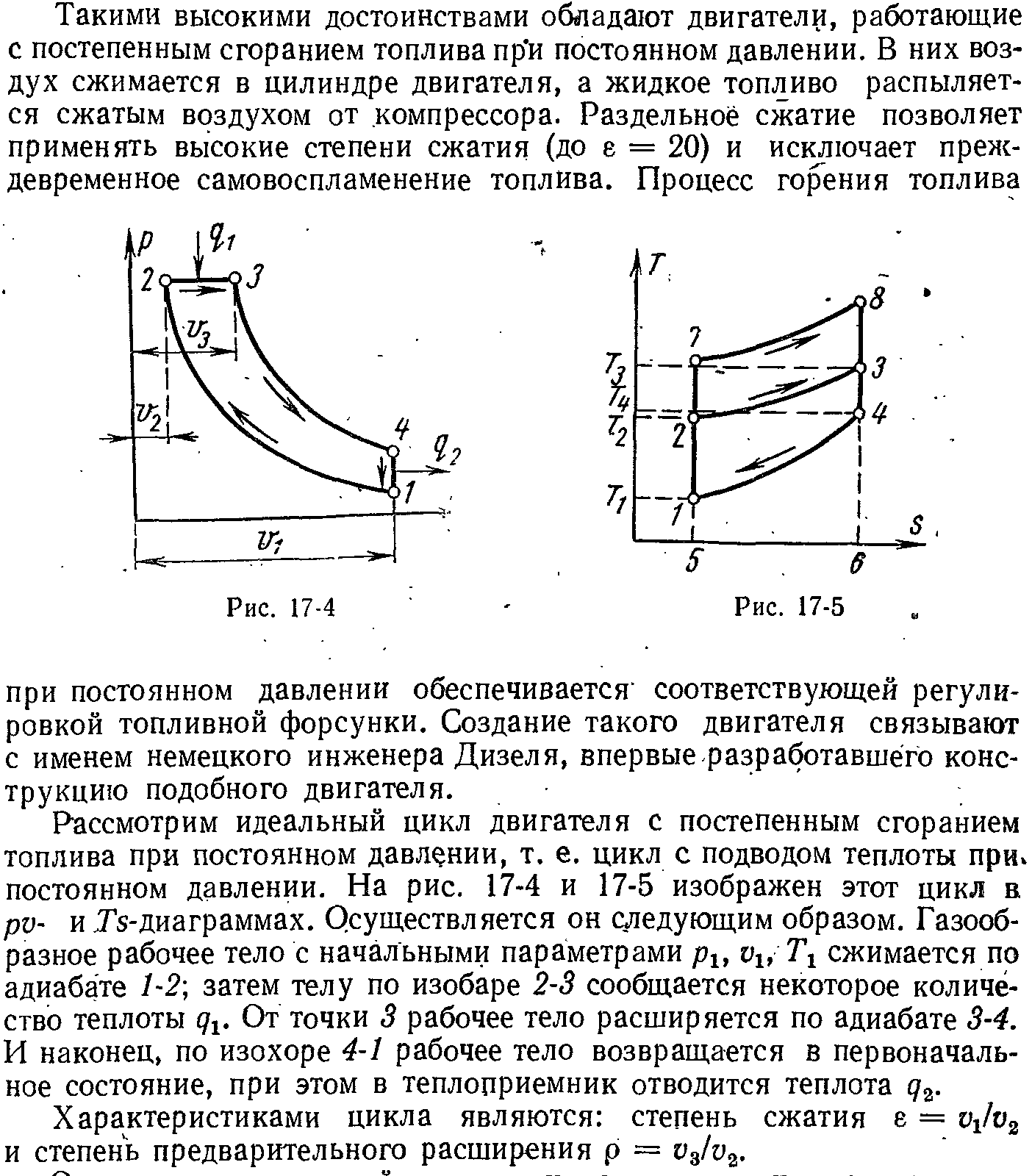
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 20
1. Цикл ДВС со смешанным сгоранием топлива.

2. Абсорбционные холодильные установки.
3. Влажный воздух.


 .
.