
- •11.Типы кристаллических решоток.
- •12.Электроотрицательность,степень окисления, валентность.
- •13.Окислительно-восстановительные реакции.
- •14.Скорость химических реакций.
- •15.Химическое равновесие и его условия.
- •16.Растворы.Способы вырожения концентрации.
- •18.Электростатическая диссоциация.Степень диссоциации.
- •19.Свойства кислот,оснований и солей с точки зрения тэд.
- •20.Электролиз.
- •21.Гидролиз.
- •24.Алканы,строение,номенклатура,химические свойства и получение.
- •25.Алкены,строение,номенклатура,химические свойства и получение.
- •26.Диеновые углеводороды,строение,номенклатура,химические свойства и получение.
- •27.Алкины,строение,номенклатура,химические свойства и получение.
- •28.Ароматические углеводороды,строение,номенклатура,химические свойства и получение.
- •29.Спирты,строение,номенклатура,химические свойства и получение.
- •31.Фенол.Физические и химические свойства.
- •32.Альдегиды,номенклатура,химические свойства и получение.Кетоны.
- •33.Карбоновые кислоты.Номенклатура,химические свойства и получение.
- •35.Эфиры (простые и сложные).
- •36.Углеводы и их классификация.Глюкоза и фруктоза.
- •37.Дисахариды и полисахариды.
- •38.Нитросоединения.
- •39.Амины.Анилин.
15.Химическое равновесие и его условия.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ –состояние системы реагирования веществ при котором скорость прямой реакции ровна скорости обратной реакции. На нее влияют: 1.Концентрация; 2.температура; 3.Давление(только для газов).
1.Переход реакционной системы от одного состояния равновесия к другому -смещение химического равновесия. H2+J2 и влево и вправо 2HJ Увеличение концентрации . Один из реагирующих веществ химического равновесия смещается в сторону расхода этого вещества.
2.Увеличение температуры смещает химическое равновесие в сторону эндотермической(-Д) реакции и наоборот.
3.Увеличение давления смещает химическое равновесие в сторону меньшего объема(числа молекул).
Направление смещения химического равновесия при изменении концентрации, температуры, давления, определяется принципом Ле Шетелье: если на систему находящуюся в равновесии происходит внешнее воздействие- из температуры, давления, концентрации, то оно благоприятствует протеканию той из двух противолежащих реакций которая ослабит это воздействие.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
2KClO 3 = 2KCl + 3O 2 ↑
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
![]()
Количественно состояние химического равновесия описывается законом действующих масс. При равновесии отношение произведения концентраций продуктов реакции (в степенях их коэффициентов) к произведению концентраций реагентов (тоже в степенях их коэффициентов) есть величина постоянная, не зависящая от исходных концентраций веществ в реакционной смеси. Эта постоянная величина называется константой равновесия – k .
16.Растворы.Способы вырожения концентрации.
Растворы – это однородные (гомогенные) дисперсные системы, состоящие из растворенного вещества и растворителя, а так же из продуктов их взаимодействия. Диффузия- разложения.Впроцессе растворения частицы, ионы, молекулы растворенного вещества под действием хаотически движущихся частиц раствора переходят в раствор образуя качественно новую однородную систему. Процесс растворения является равновестным так как на ряду с переходом частиц растворенного вещества в раствор одновременно часть частиц может удаляться из раствора. Классификация растворов: 1.по состоянию равновесия- 1)Насыщенный,при данных условиях не способствует растворению больше вещества или раствор который находится в равновесии с избыточной растворенностью вещества; 2)Ненасыщенный,если раствор вещества меньше чем в насыщенном; 3)Перенасыщенный,если раствор вещества больще чем в насыщенном.
2.Взависимости от количества растворенного веществ-
1)Концентрированный,много растворенного вещества(от 20г на 100г воды); 2)Разбавленный,небольшое количество растворенного вещества(от 0,2г до 20г на 100г воды Способы выражения концентрации растворов.
Концентрация раствора – количество растворяемого вещества содержащегося в определенном количестве раствора. Виды:
1.Массовая доля растворимого вещества ω (х) – число грамм растворяемого вещества содержащегося в 100г раствора.
1) Массовая доля раствора ω (х). Выражается отношением массы растворенного вещества m(х) к массе раствора.
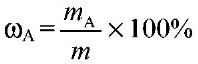 Пример:
Пример:
![]()
Где ма – масса растворенного вещества, а м- масса раствора.
Отсюда можно найти: м(растворенного вещества)=м(раствора)* ω/100% м(раствора)= м(растворенного вещества)*100%/ ω м(раствора)= м(растворенного вещества)+м(растворителя н2о) м(раствора)=объем *плотность.
2) Молярная концентрация раствора С(х) –число моль растворенного вещества содержащегося в1литре раствора.
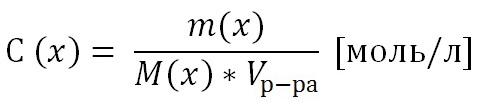
Где м(х) – масса растворенного вещества м(растворенного вещества)= Сх*М*V Сх=ню/V
Молярность: 3м –трехмолярный; 1м –одномолярный; 0,1м – децемолярный; 0,001м – милемолярный. 3.Нормальная концентрация. Число грамм эквивалента растворенного вещества содеожащегося в 1л раствора.
Cn=m(растворенного вещества)/э*v Э(кислоты)=м/n(н)
17.РАСТВОРИМОСТЬ ВЕЩЕСТВ. ТЕПЛОВЫЕ ЯВЛЕНИЯ ПРИ РАСТВОРЕНИИ.
Растворимость –свойство вещества растворяться в воде или в другом растворителе.Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях).Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.Количественная растворимость определяет концентрация насыщенности раствора. Чаще всего раствором выражено максимальное число граммов вещества которое можно растворить в 100г растворителя при данной температуре - коэффициент растворимости.
1.Зависимость растворимости от температуры. Растворимость почти всех твердых веществ с повышением температуры увеличивается. Растворимость газов в жидкостях с повышением температуры уменьшается. Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например,Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании. Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается. 2.Зависимость растворимости от плотности. 3.Зависимость растворимости от природы растворимого вещества и растворителя. Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества – наоборот. Природа растворяемого вещества. Кристаллические вещества подразделяются на:
P - хорошо растворимые (более 1,0 г на 100 г воды); M - малорастворимые (0,1 г - 1,0 г на 100 г воды); Н - нерастворимые (менее 0,1 г на 100 г воды).
ПОДОБНОЕ РАСТВОРЯЕТЬСЯ ПОДОБНЫМ.
Тепловое явление при растворении.
Растворение не просто механическое распределение частиц растворяемого вещества между частицами растворителя, а химическое взаимодействие между ними, которое заключается при соединении молекул воды с частицами растворяемого вещества. В итоге образуются кристаллогидраты.(СuSO4*5Н2О, NaСО3*10Н2О, FeО4*7Н2О).
Растворение вещества сопровождается: 1.Разложением структуры вещества, распределением его молекул или ионов во всем объеме растворителя. На что требуется затрата энергии(поглощение тепла Q1). 2.Химическое взаимодействие растворяемого вещества с растворителями (выделение тепла Q2). Если Q2 больше Q1, то при растворении тепло выделяется. Если Q2 меньше Q1, то при растворении тепло поглащаеться.
