
- •2.3. Механизм и термодинамика процесса растворения
- •2.4. Концентрация растворов и способы ее выражения.
- •3.2. Классификация буферных систем:
- •3.4. Кислотный буфер:
- •3.5. Буферные системы крови:
- •3.5. Понятие о кислотно-основном состоянии (кос) организма.
- •4.1. Основные положения координационной теории Вернера. Дентатность лигандов. Классификация комплексных соединений.
- •4.3. Классификация комплексных соединений.
- •4.4 Номенклотура комплексных соединений
- •Строение гемоглобина, хлорофилла.
- •4.6. Представления о строении металлоферментов и других биокомплексных соединений (цитохромы, цианкобаламин).
- •4.7. Диссоциация комплексных соединений. Константа нестойкости. Инертные и лабильные комплексы.
- •5.1 Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики.
- •6) Типы систем.
- •7) Процессы
- •1)Второе начало термодинамики
- •5.6. Химическое равновесие. Обратимые и необратимые по направлению реакции.
- •4.8. Металло-лигандный гомеостаз и причины его нарушения.
- •4.9. Комплексные соединения в природе, организме человека, комплексные соединения как лекарственные средства.
- •5.7. Термодинамические условия равновесия в изолированных и закрытых системах.
- •6.2. Понятие об активных молекулах; энергия активации: уравнение Аррениуса. Энергетическая диаграмма реакции. Роль стерического фактора. Понятие о теории переходного состояния.
- •6.3. Скорость реакции, средняя скорость реакции в интервале, истинная скорость. Методы определения скорости реакции.
- •6.6 Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции. Особенности каталитической активности ферментов. Уравнение Михаэлиса - Ментен и его анализ.
- •6.7 Физические и химические процессы, происходящие при хранении лекарств. Влияние условий получения, хранения и транспортировки на стабильность лекарственных веществ. Сроки годности лекарств.
- •7.1. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Поверхностная энергия Гибса и поверхностное натяжение.
- •7.2. Сорбция, адсорбция, абсорбция, капиллярная конденсация, адсорбент, адсорбат
- •7.3. Изотерма адсорбции. Уравнение Гиббса.
- •7.4. Поверхностно активные и поверхностно неактивные вещества. Изменение поверхностной активности в гомологических рядах (Правило Траубе).
- •7.5. Ориентация молекул в поверхностном слое и структура биомембран
- •7.6. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Адсорбция газов на твердых телах. Зависимость величины адсорбции от различных факторов.
- •7.8. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применение в медицине ионитов.
- •8. Биологически активные высокомолекулярные вещества
- •8.1. Полимеры. Понятие о полимерах медицинского (стоматологического) назначения.
- •8.2. Свойства растворов вмс. Особенности растворения вмс как следствие их структуры. Форма макромолекул.
- •8.3. Механизм набухания и растворения вмс. Зависимость величины набухания от различных факторов.
- •8.4. Аномальная вязкость растворов вмс. Уравнение Штаудингера. Вязкость крови и других биологических жидкостей.
- •Классификация органических реакций по количеству исходных и конечных веществ и характеру реагентов: 1. Реакции по способу разрыва и образования связей:
- •2. Реакции по направлению:
- •4) Перегруппировки (происходит миграция атомов или групп атомов от одного атома к другому)
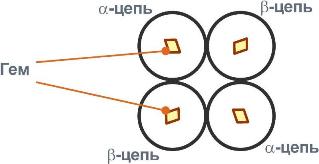
Строение гемоглобина, хлорофилла.
Сходство молекул гемоглобина и хлорофилла было установлено в начале XX века ученым Рихардом Вильштаттером.
Общим в строении хлорофилла и гемоглобина является профин – кольцо из маленьких колечек. Различие – в хвостиках, присоединенных к профину, и в атомах, расположенных внутри. У гемоглобина – это атом железа, у хлорофилла – атом магния.
Строение гемоглобина
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком - контактной поверхностью.
Строение хлорофилла
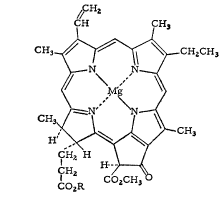 С точки зрения химического строения
хлорофилл неоднороден. Существуют
различные типы хлорофиллов. Основой
химического строения всех хлорофиллов
является сложное циклическое соединение
— порфирин, содержащий центральный
атом Mg и многоатомный гидрофобный
спиртовый остаток.
С точки зрения химического строения
хлорофилл неоднороден. Существуют
различные типы хлорофиллов. Основой
химического строения всех хлорофиллов
является сложное циклическое соединение
— порфирин, содержащий центральный
атом Mg и многоатомный гидрофобный
спиртовый остаток.
4.6. Представления о строении металлоферментов и других биокомплексных соединений (цитохромы, цианкобаламин).
Такие вещества, находясь в биологических материалах, обеспечивают транспорт ионов через мембраны и поэтому называются ионофорами. Катион в ионофоре окружен гидрофобной оболочкой, за счет которой он может свободно плавать в гидрофобной среде.
С помощью другого полипептида – грамицидина осуществляется транспорт катионов натрия, но по эстафетному механизму. Этот полипептид свернут в «трубочку», внутренняя поверхность которой выстлана кислородсодержащими группами. В результате получается достаточно большой длины гидрофильный канал с определенным сечением, соответствующим размеру иона натрия. Ион натрия, входя в гидрофильный канал с одной стороны, передается от одной к другой кислородным группировкам подобно эстафете по ионопроводящему каналу.
Циклическая молекула полипептида имеет внутримолекулярную полость, в которую может войти субстрат определенного размера, геометрии по принципу ключа и замка. Полость таких внутренних рецепторов окаймлена активными центрами (эндорецепторами). В зависимости от природы иона металла может происходить нековалентное взаимодействие (электростатическое, образование водородных связей, силы Ван-дер-Ваальса) со щелочными металлами и ковалентное со щелочноземельными металлами. В результате этого образуются супрамолекулы – сложные ассоциаты, состоящие из двух или более частиц, удерживаемых вместе межмолекулярными силами.
4.7. Диссоциация комплексных соединений. Константа нестойкости. Инертные и лабильные комплексы.
При растворении в воде комплексных соединений, обычно они распадаются на ионы внешней и внутренней сфер подобно cильным электролитам, так как эти ионы связаны ионогенно, в основном, электростатическими силами. Это оценивается как первичная диссоциация комплексных соединений.
K[Ag(CN) 2] ® К + + [Ag(CN) 2]—
Вторичная диссоциация комплексного соединения – это распад внутренней сферы на составляющие ее компоненты. Этот процесс протекает по типу слабых электролитов, так как частицы внутренней сферы связаны неионогенно (ковалентной связью). Диссоциация носит ступенчатый характер:
[Ag(CN)2]— [AgCN] + CN—
1 ступень
[AgCN] Ag+ + CN—
2 ступень
Для качественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию называемую константой нестойкости комплекса (Кн). Для комплексного аниона [Ag(CN)2]— выражение константы нестойкости имеет вид:
[Ag+] [СN—]2
Кн = ——————
[Ag(СN)—2]
Чем меньше значение Кн, тем более устойчивой является внутренняя сфера комплексного соединения, то есть – тем меньше она диссоциирует в водном растворе. В последнее время вместо Кн используют значение константы устойчивости (Ку). Чем больше значение Ку, тем более стабильный комплекс.
1
Ку = ——
Кн
Константы устойчивости позволяют прогнозировать направление лигандообменных процессов.
Для кинетической характеристики комплексных соединений используются понятия – лабильный (быстро вступающий в реакцию) и инертный (медленно вступающий в реакцию). Лабильными комплексами считаются такие, которые полностью обмениваются лигандами в течение 1 минуты при комнатной температуре и концентрации раствора 0,1 М.
У лабильных ионов реакции замещения лигандов происходят быстро, устанавливается быстро равновесие. У инертных ионов реакции замещения лигандов протекают медленно.
Лабильность комплексов связана с электронной структурой центрального атома. Инертность комплексов свойственна главным образом ионам с незаконченной d – оболочкой.
