
- •2.3. Механизм и термодинамика процесса растворения
- •2.4. Концентрация растворов и способы ее выражения.
- •3.2. Классификация буферных систем:
- •3.4. Кислотный буфер:
- •3.5. Буферные системы крови:
- •3.5. Понятие о кислотно-основном состоянии (кос) организма.
- •4.1. Основные положения координационной теории Вернера. Дентатность лигандов. Классификация комплексных соединений.
- •4.3. Классификация комплексных соединений.
- •4.4 Номенклотура комплексных соединений
- •Строение гемоглобина, хлорофилла.
- •4.6. Представления о строении металлоферментов и других биокомплексных соединений (цитохромы, цианкобаламин).
- •4.7. Диссоциация комплексных соединений. Константа нестойкости. Инертные и лабильные комплексы.
- •5.1 Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики.
- •6) Типы систем.
- •7) Процессы
- •1)Второе начало термодинамики
- •5.6. Химическое равновесие. Обратимые и необратимые по направлению реакции.
- •4.8. Металло-лигандный гомеостаз и причины его нарушения.
- •4.9. Комплексные соединения в природе, организме человека, комплексные соединения как лекарственные средства.
- •5.7. Термодинамические условия равновесия в изолированных и закрытых системах.
- •6.2. Понятие об активных молекулах; энергия активации: уравнение Аррениуса. Энергетическая диаграмма реакции. Роль стерического фактора. Понятие о теории переходного состояния.
- •6.3. Скорость реакции, средняя скорость реакции в интервале, истинная скорость. Методы определения скорости реакции.
- •6.6 Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции. Особенности каталитической активности ферментов. Уравнение Михаэлиса - Ментен и его анализ.
- •6.7 Физические и химические процессы, происходящие при хранении лекарств. Влияние условий получения, хранения и транспортировки на стабильность лекарственных веществ. Сроки годности лекарств.
- •7.1. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Поверхностная энергия Гибса и поверхностное натяжение.
- •7.2. Сорбция, адсорбция, абсорбция, капиллярная конденсация, адсорбент, адсорбат
- •7.3. Изотерма адсорбции. Уравнение Гиббса.
- •7.4. Поверхностно активные и поверхностно неактивные вещества. Изменение поверхностной активности в гомологических рядах (Правило Траубе).
- •7.5. Ориентация молекул в поверхностном слое и структура биомембран
- •7.6. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Адсорбция газов на твердых телах. Зависимость величины адсорбции от различных факторов.
- •7.8. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применение в медицине ионитов.
- •8. Биологически активные высокомолекулярные вещества
- •8.1. Полимеры. Понятие о полимерах медицинского (стоматологического) назначения.
- •8.2. Свойства растворов вмс. Особенности растворения вмс как следствие их структуры. Форма макромолекул.
- •8.3. Механизм набухания и растворения вмс. Зависимость величины набухания от различных факторов.
- •8.4. Аномальная вязкость растворов вмс. Уравнение Штаудингера. Вязкость крови и других биологических жидкостей.
- •Классификация органических реакций по количеству исходных и конечных веществ и характеру реагентов: 1. Реакции по способу разрыва и образования связей:
- •2. Реакции по направлению:
- •4) Перегруппировки (происходит миграция атомов или групп атомов от одного атома к другому)
1.1. Химия и медицина.
Химия-наука о веществах и их превращениях, связанных с изменениями электрического окружения атомных ядер.
Задачи химии:
Изучить свойства элементов
Изучить основные физические и физико-химические процессы, обеспечивающие существование организма в окружающей среде
Методы химии:
Химические методы анализа
Физические методы анализа
Физико-химические методы анализа
Отличительная черта современной медицины-активное внедрение достижений химии в теорию и практику исследования функций живого организма. Поэтому особую роль преобретают знания основ биофизической химии и свойств биогенных элементов, которые служат фундаментом при последущем изучении биоорганической и биологической химии,фармакологии, физиологии, гистологии, санитарии и гигиены, анастезиологии.
2. Протолитические равновесия и процессы.
Гетерогенные равновесия и процессы в растворах электролитов
2.1 Раствор-гомогенная(однородная) система, состоящая из двух или более компонентов и продуктов их взаимодействия.
Компоненты раствора: растворитель и растворенное вещество.
Идеальный раствор- раствор,образование которого не сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом.
2.2 Роль воды и растворов в жизнедеятельности. Многие химические процессы протекают при условии, что вещества находятся в растворённом состоянии. Важнейшими биожидкостями являются растворы солей, белков, углеводов в воде. Усвоение пищи связано с переходом веществ в растворимое состояние. Биожидкости учавствуют в транспорте питательных веществ: кислорода, лекарственных препаратов к органам и тканям и выводят продукцию распада.
Физико-химические свойства воды, обусловливающие ее уникальную роль как единственного биорастворителя:
температура плавоения и кипения аномально высокая или низкая,
высокая теплоёмкость,
высокое диэлектрическое пронизывание,обеспечивающее высокие скорости протекания биохимических реакций,
мгновенная передача нервных импульсов,
высокий дипольный момент увеличивающий растворяющую способность полярных веществ, благополучно образовавшихся молекул биополимеров в водных растворах.
Низкая вязкость способная выполнять транспортные функции
Влияние внешних условий на растворимость.
Растворимость зависит от:
Природы растворенного вещества и растворителя
Температуры
Давления
Присутствие в растворе других веществ
2.3. Механизм и термодинамика процесса растворения
разрушение связи в исходном веществе происходит с поглощением энергии
частичное или полное разрушение связей между молекулами растворителя с поглощением энергии
сольватация (гидратация) с выделением энергии
самопроизвольное перемещение раствора или равномерное распределение сольватов, идет с поглощением энергии
Закон Фаянса
![]()
2.4. Концентрация растворов и способы ее выражения.
Концентрацией называется величина, показывающая сколько растворенного вещества (в граммах, молях, моль - эквивалентах) содержится в определенном количестве раствора (в литре, миллилитре, граммах) или растворено в определенном количестве растворителя (килограмме).
Существуют различные способы численного выражения состава растворов: молярная, моляльная, нормальная, процентная концентрации, титр
С = n/V(р-ра)
С = р(плотность)*10*W/М
ω = mраств. в-ва ·100%/m р-ра
2.5. Растворимость газов в жидкостях и ее зависимость от различных факторов.
для газов при повышении температуры растворимость уменьшается
Если растворители относятся к одному и тому же классу соединений, то растворимость газа часто мало зависит от индивидуальных свойств растворителя.
В газах с ростом давления увеличивается растворимость
Закон Сеченова: В присутствии электролитов растворимость газов в жидкостях уменьшается.
2.6. Коллигативные свойства разбавленных растворов неэлектролитов:
Осмотическое давление-тт
Понижение давления насыщенного пара-
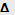 Р
РПовышение температуры кипения- Ткип.
Понижение тмпературы замерзания- Тзам.
Закон Рауля:при постоянной температуре относительное понижениедавление насыщенного пара растворителя над идеальным раствором нелетучего вещества(неэлектролита) равно молярной доле растворенного вещества.
(р![]() -р)/p
=n(n+N)
-р)/p
=n(n+N)
понижение температуры замерзания
Tзам.=К*b(х)
повышение температуры кипения
![]()
Осмос-самопроизвольное проникновение(диффузия) растворителя через полупроницаемую мембрану в растворе.
Осмотическое давление-это величина минимального гидростатического давления, которое нужно приложить, чтобы осмос прекратился.
Осмос в биологических системах: биологические жидкости-кровь,лимфа,слюна-это водные растворы низкомолекулярных(хлоридов Са,Na,К) или высокомолекулярных соединений:белков,липидов и также форменных веществ-эритроцитов и лейкоцитов.Осмотическое давление биологических жидкостей у разных организмов неодинаково.
ОСМОЛЯЛЬНОСТЬ(осмолярность) - концентрация осмотически активных частиц в растворе, выраженная в количестве осмолей на килограмм растворителя.
осмоляльность - молярное количество осмотически активных частиц на килограмм растворителя, мосм/кг
осмолярность - молярное количество осмотически активных частиц на литр раствора, мосм/л
Изотанические растворы-растворы, имеющие одинаковое осмотическое давление.
Гипертонический раствор-из двух растворов,раствор с большим осмотическим давлением.
Гипотанический раствор-из двух растворов,раствор с меньшим осмотическим давлением.
Онкотическое давление- доля осмотического давления, создаваемая высокомолекулярными компонентами раствора.
2.8. Плазмолиз- высушивание клетки (Н2О выходит из кл.) в результате помещения её в гипертонический р-р.
Цитолиз-разрыв оболочки клетки в результате поступления в неё воды извне при помещении клетки в гипотонический р-р.
2.9. В водных р-рах эл-литов наблюаются отклонения от законов разбавления. Для приведения в соответствие теоретические расчёты Вантгоф ввёл изотонический коэфф.
В Р-рах эл-литов число частиц больше чем число не эл-литов при одинаковом кол-ве в-ва. Сосм.= С1+С2+…Сн=Сi Т.о. i- число , показывающее, во сколько раз число частиц эл-литов больше чем в не эл-литах той же конц.
Устойчивость ВМС и скорость биохимических реакций в значительной мере зависит от концентрации природы, присутствующих в жидкости и тканях ионов. Организм человека постоянно теряет воду и значит кол-во эл-литов. Концентрация ионов в тканях поддерживается примерно постоянным- ионный гомеостаз. Обмен ионов К+ важен для работы нервных и мышечных кл. Катионы Са+ влияют на проницаемость мембран , сокращении мышц, способность синтезирования белков, свёртывание крови, уменьшение возбуждения нервной системы.
Анионы слабой кислоты и ионы белков участвуют в регуляции кислотно-основного равновесия.
Водно-эл-литный баланс поддерживается не только за счёт физиохим. процессов (гидротация, осмос, проницаемость) ,Но и в результате биологических процессов (поступление в-в в орг., накопление в клетках и межклеточной жидкости выделение из орг.)
2.10.Слабые эл-литы: сера,бензол, бензин, сахар.
Кдис. = [H+]*[CH3COO-]/[CH3COOH]= (α^2* Co)/ (1-α)
Данная константа является константой ионизации слабого электролита. Она не зависит от исходной концентрации веществ, а зависит только от природы электролита и растворителя, а также от температуры. Константа ионизации характерна только для слабых электролитов.
Степень диссоциации эл-лита возрастает при добавлении к р-ру слабого эл-лита или сильного, имеющего общий ион- закон разбавления . α= √( Кдис.*V)
2.11. Расчет рН в растворах слабых одноосновных кислот и оснований проводят по формулам (4-5) рН = 1/2 (рКк – lgCк) (4) рН = 14 - 1/2( рКО - lg CО) (5)
2.12. Сильные эл-литы: NaCl, К-ты, NaOH
Активность- эффективная концентрация в соответствии с которой эл-лит участвует в различных процессах. а=f*c
a-активность;f-коэффициент акт.с-конц.
Для количественной характеристики межионного электростатического взаимодействия введено понятие ионной силы
I=0,5 ΣCiZi
Теория Дебая-Хюккеля, р-ров сильных к-т. Для сильных эл-литов степень диссоциации явл. Кажущейся α= (i-1)/(n-1)
2.13. Расчет рН в растворах сильных кислот и оснований
В
растворах сильных кислот и оснований
протолитическая реакция взаимодействия
с водой,
например HAn + H2O ![]() H3O+ +
An-, целиком сдвинута вправо.
H3O+ +
An-, целиком сдвинута вправо.
Вследствие полной диссоциации концентрация ионов водорода равна концентрации одноосновной кислоты, [H+] = Cкисл (без учета ионной силы раствора):
pH = -lg[H+] = -lg Cкисл (2.4.1)
В растворах сильных однопротонных оснований концентрация [OH -] ионов равна концентрации основания:
[OH -] = Cосн ;
![]() (2.4.2)
(2.4.2)
Для двухосновных сильных кислот и оснований необходимо при расчете концентраций [H+] или [OH -] учитывать их общую концентрацию за счет диссоциации.
2.14. Протолитические равновесия - реакции, связанные с переносом протона (реакции нейтрализации, гидролиза и диссоциации).
Протолитическая теория кислот и оснований. К-та- всякое в-во, молек. Частицы которого способны отдавать электрон. Основание- в-во, молек. Частицы которого способны присоединять протон.
Электронная теория Льюиса. Кислота- в-во, принимающее электронные пары (акцептор эл.) Основание- в-во., поставляющее эл. Для образования хим. Св.( донор эл.)
2.15. СН3СООН + Н2О ↔ Н3О+ + СН3СОО–
константа равновесия имеет вид
Здесь в числителе дроби стоят равновесные концентрации ионов - продуктов диссоциации, а в знаменателе - равновесная концентрация недиссоциированных молекул.
NH3·HOH ↔ NH4+ + OH–
существует константа основности, определяющая полноту протекания протолиза слабого основания при данной температуре
Амфолиты- молекулы или ионы, способные присоединять протон.
Изоэлектрическая точка-значение рН среды, при котором ам. к-та находится в водном р-ре только в молекулярной форме инее перемещается под действием внешнего эл. поля.
pl= 0.5(pKa(CH3COOH-)+pKa(NH3+)
2. 16 Автопротолиз –обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
Ионное произведение-произвед конц ионов Н и ионов ОН в воде или водных р-рах, константа атопротолиза воды.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН)- величина, характеризующая концентрацию ионов водорода в растворах.
рН = -lg[H+]
2.17 Если растворителем является вода, то процесс – гидролиз (частный случайсольволиза).
Гидролиз солей – это взаимодействие соли c молекулами воды, приводящее к образованию высокодиссоциированных соединений.
2.18 гидролиз по катиону:
![]()
![]()
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
Степень гидролиза измеряется отношением кол-ва гидролизованного в-ва к общ кол-ву растворенного в-ва:
а=Кг/с
Кг=Кw/Кд
pH=-lgКа-lg*ск-та/ссоли
2.19 . гидролиз по аниону:
![]()
![]()
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2.20 Гидролиз соли слабой кислоты и слабого основания:
![]()
![]()
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
2.21 роль гидролиза: участвует в процессах питания, выделения, поддержания гомеостаза перераспределения энергии
2.22 Гетерогенноеравновесие — это равновесие, устанавливающееся на границе раздела фаз.
Гетерогенные процессы- процессы растворения, кристаллизации, испарения, конденсации, химические реакции на границе раздела двух фаз, гетерогенный катализ и др.
Константа растворимости(произведение) (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
2.23 услов обр осадка: если в р-ре произведение реальных конц ионов больше, чем произведение растворимости при данной t, то осадок выпадает.
Если возникает необходимость растворить осадок, то следует уменьшить в его насыщ р-ре конц соответствующих ионов
2.24. В организме человека наиболее важные гетерогенные процессы с участием неорганических соединений протекают прежде всего при образовании костной ткани, а также различного вида камней при почечной и желчнокаменной болезнях.
Образование нерастворимых соединений начинается с плазмы крови. В плазме кроме компонентов H2CO3, и HCO3-, H2PO4- и HPO42-, обеспечивающих кислотно-основное равновесие, содержатся катионы Са2+, анионы молочной кислоты (лактаты), а также белки. Эти компоненты участвуют в образовании малорастворимого гидрофосфата кальция СаНРO4 и в процессах комплексообразования.
В клетках костной ткани остеобластах, интенсивно омываемых кровью, происходит минерализация – конечный этап образования костной ткани. Основным минеральным компонентом костной ткани является гидроксифосфат кальция Са5(РО4)3ОН (Ks = 1,6·10-58), часто называемый гидроксиапатитом. Образование костной соли можно отразить общим уравнением:
Ca2+ + HPO42–→CaHPO4
3CaHPO4 + Ca2+ + 2OH– → Ca4H(PO4)3 + 2H2O
Ca4H(PO4)3 + Ca2+ + 2OH–→ Ca5(PO4)3OH + H2O
Формирование костной ткани в остеобластах происходит в результате контролируемого коллагеном процесса кристаллизации гидроксиапатита из ионов кальция и фосфатов.
При небольшом повышении содержания протонов кость начинает растворяться, отдавая вначале катионы кальция, а при большей кислотности среды происходит ее полный распад:
Сa5(PO4)3OH + 7H+ → 3H2PO4- + 5 Ca2+ + H2O.
При увеличении концентрации свободных ионов Са2+ в плазме крови равновесие сдвигается, это приводит к отложению кальция в костной ткани. При снижении концентрации ионов Са2+ в плазме крови наблюдается растворение минеральных компонентов костной ткани. Таким образом, костную ткань можно рассматривать как кальциевый буфер.
2.25. Изоморфизм - свойство атомов (или ионов) одних веществ заменять в структуре атомы (или ионы) других. Явления изоморфизма очень широко распространены в минералах.
ИЗОМОРФИЗМ, явление, заключающееся в том, что вещества неодинакового, но в известной степени аналогичного химического состава кристаллизуются в одинаковой кристаллографической системе в одинаковом кристаллическом классе. Близкая кристаллическая структура изоморфных соединений находит себе выражение в том факте; что кристаллы одного из изоморфных друг другу веществ, будучи погружены в насыщенный раствор другого изоморфного вещества, могут обрастать с поверхности слоем этого вещества, а также и в том, что изоморфные друг другу вещества могут выкристаллизовываться из смешанного раствора в виде общих кристаллов; такие кристаллы содержат оба вещества в непостоянном количественном отношении, зависящем от количественного соотношения изоморфных веществ в растворе
В организме человека ионы Са2+ могут образовывать разные малорастворимые соединения, которые называют камнями. Камнеобразование – сложный физико-химический процесс, в основе которого лежит не только образование малорастворимых соединений, но и нарушение коллоидного равновесия в тканях организма. Нарушение коллоидного равновесия вызывается уменьшением толщины защитного слоя из ионов стабилизатора и белковой защиты вокруг ультрамикрокристаллов соединения, что приводит к их слипанию с образованием более крупных кристаллов. Таким образом, формирование камней происходит из коллоидных частиц в результате процесса коагуляции.
Почечнокаменная болезнь связана с образованием в мочевых органах камней различного состава. При повышении концентрации мочевой кислоты образуются ее малорастворимые соли – ураты кальция. Их образованию способствует кислая среда мочи (рН < 5). В щелочной моче (рН > 7) могут образовываться малорастворимые фосфаты кальция. Малорастворимые оксалаты кальция могут встречаться как в кислой, так и в щелочной моче.
2.26. К обменным реакциям протекающим в растворе электролитов , относятся реакции осаждения и растворения. Реакции осаждения- это реакции, идущие с выпадением осадков.
Метод осаждения используют в клиническом анализе хлоридов в моче, желудочном соке, крови, в санитарно-гигиенической практике – при анализе питьевой воды.
Реакции осаждения лежат в основе метода аргентометрии, который широко применяется в количественном анализе фармацевтических препаратов. Аргентометрию используют для анализа роданидов, хлоридов, бромидов, йодидов, щелочноземельных металлов. Сущность метода заключается в выделении определяемого вещества в виде труднорастворимых осадков солей серебра.
Кальция хлорид используют в качестве антидота при отравлении солями магния, а также оксалат и фторид ионами. Применение препарата в первом случае основано на взаимозамещаемости ионов кальция и магния в организме, а во втором случае- на образовании нетоксичных малорастворимых соединений кальция оксалата и фторида.
Ca2+ + C2O42- = CaC2O4 ; Ca2+ + 2F- = CaF2
3.1. Буферные растворы – р-ры, содержащие промежуточную равновесную систему, способную поддерживать практически постоянное значение pH при разбавление или добавление небольшого количества кислоты или основания.
Буферное действие раствора обусловлено смещением кислотно-основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН- в результате реакции этих ионов и компонентов буферной системы с образованием малодиссоциированных продуктов.
Буферные растворы играют большую роль в жизнедеятельности. К числу исключительных свойств живых организмов относится их способность поддерживать постоянство pH биологический жидкостей, тканей и органов – кислотно-основной гомеостаз. Это постоянство обусловлено наличием нескольких буферных систем, входящих в состав этих тканей.
