
- •1. Опытные законы идеального газа.(p;V;t)
- •2. Уравнение состояния идеального газа
- •4. Закон Максвелла. Функция распределения молекул по скоростям
- •5. Барометрическая формула
- •7. Явление переноса
- •8.Закон равномерного распределения энергии по степеням свободы
- •9.Внутренняя энергия(u). Теплота. I начало термодинамики
- •10. Теплоемкость. Сv и Сp
- •11. Применение I начала термодинамики к изопроцессам
- •13) Обратимые и необратимые процессы
- •14. II начало термодинамики. Тепловые и холодильные машины
- •15. Цикл Карно-Обратимый круговой процесс, в котором совершается превращение теплоты в работу (или работы в теплоту)
1. Опытные законы идеального газа.(p;V;t)
Идеальный газ - это модель разреженного газа, в которой пренебрегается взаимодействием между молекулами (все соударения молекул абсолютно упругие, нет взаимодействия между молекулами)
1) з-он Бойля-Мариотта. «изотермический процесс» T=const, m=const
T2>T1; PV=const, P1V1=P2V2
2) з-он Гей-Люссака «изобарный процесс» m=const, p=const
P1>P2; V1/V2=T1/T2; V/T=const
3) з-он Шарля «изохорный процесс» V=const, m=const
V1>V2; P1/P2=T1/T2
*моли любых газов занимают один и тот же обьем.
Vm=22,4л (моль)
Vm=22,4*10^-3 (m^3/моль) – молярный обьем.
*В одном моле различных веществ одно и тоже кол-во малекул
N(A)=6,022*10^23моль^-1
2. Уравнение состояния идеального газа
Идеальный газ - это модель разреженного газа, в которой пренебрегается взаимодействием между молекулами (все соударения молекул абсолютно упругие, нет взаимодействия между молекулами)
F(p;v;t) = 0
PV/T=const – ур-ие Клайперона.
PVm=RT – ур-ие Менделеева.
R-универсальная газовая постоянная (8.31 Дж/моль*К)
.m=N(A)*m0 – масса газа
.m/M= ν – кол-во вещества
*PV=(m/M)*RT – ур-ие Менделеева-Клайперона
PVm=RT, P=R*T/Vm=k*N(A)*T/Vm=k*n*T =>
*p=nkT
.n=N(A)/Vm – концетрация малекул
.k- постоянная больцмана=R/N(A)= 1.38*10^-23(Дж/k)
3. Основное уравнение молекулярно – кинетической теории газа связывает параметры состояния газа с характеристиками движения его молекул. Уравнение Клаузиуса: давление идеального газа численно равно 2/3 средней энергии поступательного движения молекул, заключенных в единице объема. Уравнение Больцмана: Средняя кинетическая энергия поступательного движения молекул идеального газа пропорциональна термодинамической температуре и зависит только от нее.
![]()
-
основное уравнение МКТ идеального газа.
Выведено в предположении, что давление
газа есть результат ударов его молекул
о стенки сосуда.
Это
же уравнение в другой записи:
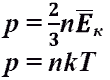
![]() .
.
4. Закон Максвелла. Функция распределения молекул по скоростям
Функция
распределения молекул по скоростям
показывает,
какова вероятность того, что скорость
данной молекулы имеет значение,
заключенное в единичном интервале
скоростей, включающем данную скорость
или каково относительное число молекул,
скорости которых лежат в этом интервале.
![]() Закон
Максвелла о распределении молекул по
скоростям:
Закон
Максвелла о распределении молекул по
скоростям:
![]()
Существуют три скорости, характеризующие состояние газа:
1) наиболее вероятная v(в)= √2RT/М;
2) средняя <v>=√8RT/(πМ)
3) средняя квадратичная <v(кв)> = √3RT/М
5. Барометрическая формула
Распределение Больцмана.
1) Сила тяжести стремится прижать все малекулы к земле.
2) тепловое движение малекул стремится разбросать все малекулы по всему обьему.
Причины стационарного состояния - давление газа с высотой убывает. P-(P+dP)=p*g*dh
=> dP= -pg*dh (P-давление) (p-плотность*ро*)
P=p*RT/M => p=pM/RT
Давление p=nkT
Распределение больцмана – n=n0*e^(Mgh/RT)
Общая барометрическая формула:
P2=P1*e^((-Mg*(h2-h1))/RT)
6.Эффективный диаметр. Средняя длина свободного пробега молекул.
Эффективный диаметр - минимальное расстояние на которое могут сблизиться малекулы. (d=10^-10м)
Под средней длиной свободного пробега понимают среднее расстояние, которое проходит молекула между двумя последовательными соударениями
За секунду молекула в среднем проходит расстояние, численно равное ее средней скорости . Если за это же время она испытает в среднем столкновений с другими молекулами, то ее средняя длина свободного пробега, очевидно, будет равна: ƛ=<V>/<Z >
Z – среднее число столкновений молекулы. V – средняя скорость. ƛ – средняя длина св.пробега.
ЗА 1 секунду!
Средняя длина свободного пробега молекул какого-то газа:
ƛ=1/((√2)*n*π*d^2)
