
- •1. Материальный баланс химических реакций и его характеристика
- •2. Безразмерные характеристики материального баланса
- •3. Концентрация, парциальное давление и мольные доли
- •4. Скорость превращения веществ, скорость реакции и кинетические уравнения
- •5. Экспериментальные установки для кинетических исследований и характеристические уравнения идеальных реакторов
- •6. Идеальный периодический реактор (рпс) и его характеристическое уравнение
- •7. Реактор идеального вытеснения (рив) и его характеристическое уравнение
- •8. Реактор полного идеального смешения (рпс) и его характеристическое уравнение
- •9. Гипотеза о схеме превращений и способы её подтверждения
- •10. Механизм и кинетика элементарных реакций
- •11. Механизм и кинетика сложных реакций
- •12. Основы кинетического исследования
- •13. Интегральный метод обработки опытов по уравнениям с одним неизвестым параметром
- •13.1. Необратимые простые реакции в периодических условиях.
- •13.2. Необратимые простые реакции в условиях идеального вытеснения.
- •13.3 Обратимые реакции в интегральных условиях.
- •14. Дифференциальный метод обработки для простых и обратимых реакций
- •15. Интегральные методы исследования параллельных реакций
- •15.1. Параллельные необратимые реакции одинакового порядка
- •15.2. Метод конкурирующих реакций
- •16. Интегральные методы исследования последовательных реакций
- •17. Исследование влияния температуры
- •18. Удельная производительность реакторов и их сочетаний
- •18.1. Реакторы ипр
- •18.2. Непрерывно-действующие реакторы
- •18.3. Реакторы идеального вытеснения
- •18.4.Реакторы полного смешения
- •18.5. Секционированные реакторы и каскады реакторов
- •18.6. Сочетания реакторов
- •19. Оптимизация процессов
- •19.1.Последовательные необратимые реакции:
- •19.2. Последовательно-параллельные реакции
- •20. Влияние типа реакторов и способа введения реагентов на селективность процесса
- •21. Экономические критерии и их применение для оптимизации процесса
- •Вопросы для контроля
- •Теория химико-технологических процессов органических веществ
- •625000, Тюмень, ул. Володарского, 38.
- •6 25039, Тюмень, ул. Киевская, 52.
10. Механизм и кинетика элементарных реакций
Элементарные реакции протекают в одну необратимую стадию без образования каких-либо промежуточных частиц или комплексов. К ним не относятся переходные состояния или активированный комплекс, через которые идет любая элементарная реакция. В элементарных реакциях применим закон действующих масс и их скорость пропорциональна концентрации каждого реагента в степени равной его стехиометрическому коэффициенту. По числу молекул, принимающих участие в элементарной реакции, они бывают моно-, би-, и тримолекулярными.
А В + … r = k[A];
A + Y B + … r = k[A][Y];
2A B + … r = k[A]2;
k – константа скорости
[A] и [Y] – равновесные концентрации или парциальные давления
Порядок реакции по какому-либо веществу равен показателю степени, в который его концентрация входит в кинетическое уравнение, а суммарный порядок равен сумме этих показателей. Таким образом, для элементарной реакции порядок, молекулярность и стехиометрические коэффициенты совпадают.
Размерность констант скорости может быть найдена делением размерности скорости на размерность произведения концентраций или парциальных давлений. Для гомогенных жидкофазных реакций размерность констант скорости будет:
1-й порядок:
![]() ;
;
2-й порядок:
 ;
;
n-й порядок:
![]() ;
;
Для жидкофазной гетерогенно-каталитической реакции получим общее выражение для константы скорости реакции:
n-й порядок
![]() ;
;
Для газофазной гомогенной реакции:
n-й порядок:
![]() ;
;
Для газофазной гетерогенной реакции:
n-й порядок:
![]() ;
;
Такие же размерности констант и для соответствующих неэлементарных реакций.
Рассмотрим основные положения теории элементарной реакции. Известно, что каждая элементарная реакция протекает через переходное состояние, как активированный комплекс, в котором происходит образование новых химических связей и ослабление прежних связей.
Для элементарных реакций замещения, расщепления, присоединения. Принято эти переходные состояния изображать следующим образом:
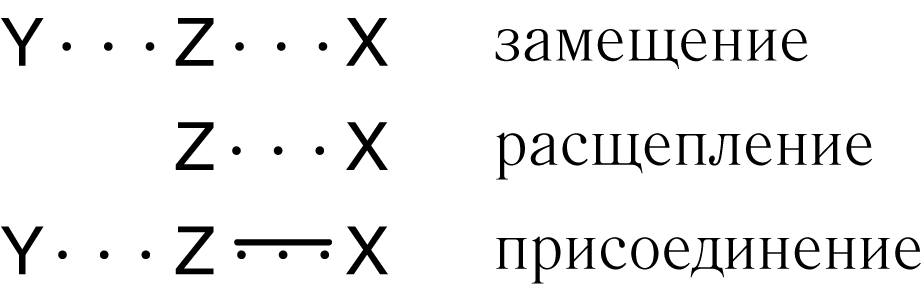
Представим графически энергетическую диаграмму химической реакции на рис. 10.1:
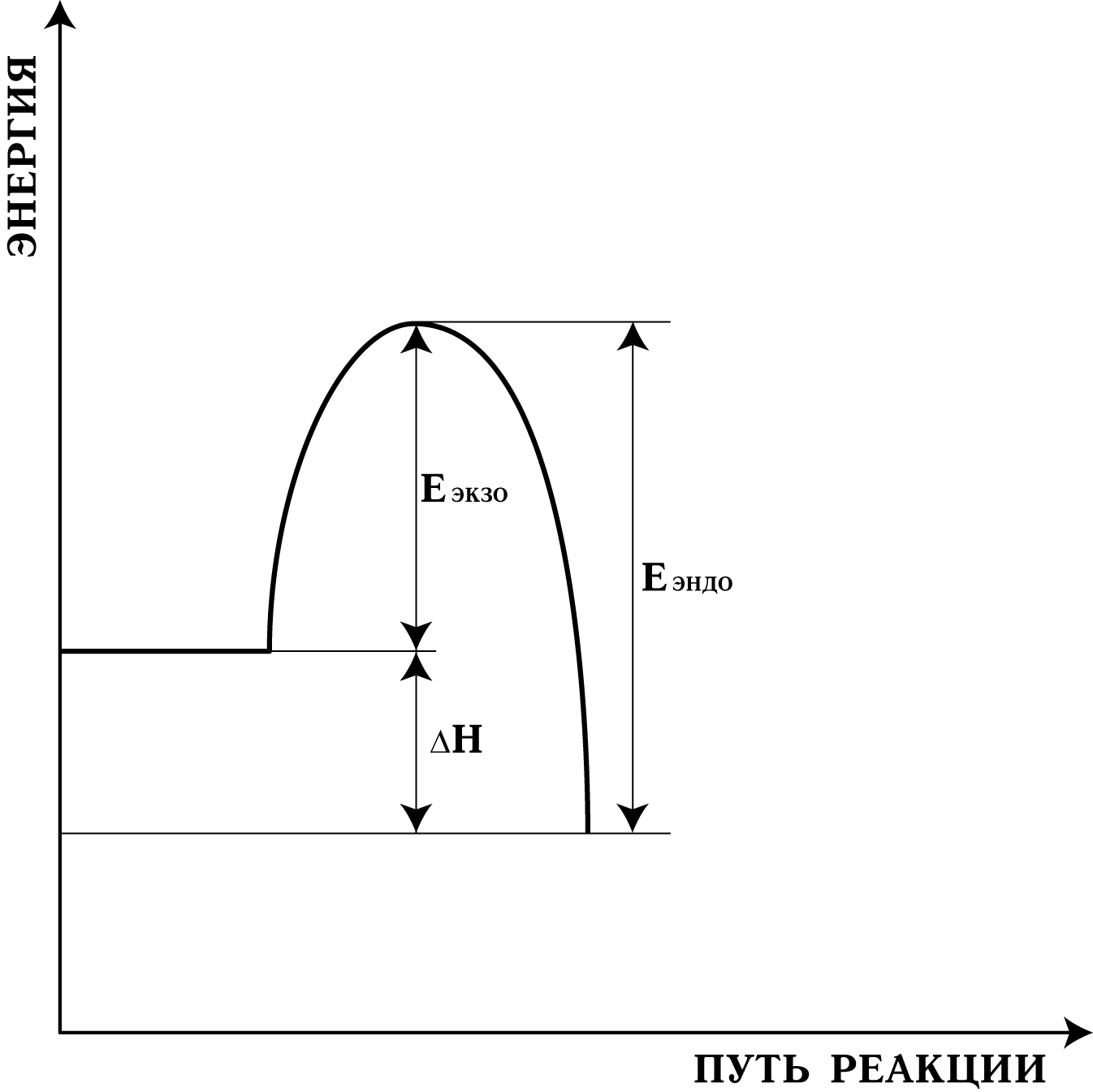
Рис. 10.1. Энергетическая диаграмма элементарной реакции.
На диаграмме переходному состоянию соответствует максимум энергии системы, а разность между ней и энергией начального состояния равна энергетическому барьеру, который должны преодолевать реагенты. Эта разность и есть энергия активации элементарной реакции. А разность между начальной и конечной энергией равна энтальпии реакции Н.
Для обратимых реакций справедливо соотношение:
Еэндо = Еэкзо + Н; (10-1)
В теории абсолютных скоростей реакции Эйринг и Поляни приняли, что активированный комплекс находится в обычном, термодинамическом равновесии с исходными реагентами. Это равновесие можно охарактеризовать активационными параметрами: свободной энергией активации G, энтропией активации S и энтальпией активации Н между которыми осуществляется термодинамическая связь.
Н = G + T·S;
G = – R∙T∙lnK – уравнение равновесия активированного комплекса.
Уравнение скорости мономолекулярного распада этого комплекса в продукты реакции:
![]() ;
;
k – постоянная Больцмана
h – постоянная Планка
и уравнение Аррениуса приводят к выражению для константы скорости элементарной реакции:
![]() ; (10-2)
; (10-2)
Из сравнения уравнения (10-2) с обычной формой уравнения Аррениуса:
![]()
Видно, что предэкспоненциальный множитель k0 последнего уравнения, являются функцией энтропии реакции т.е.
![]() ; (10-2a)
; (10-2a)
k0 = f(S);
Энтропия дает некоторое представление о механизме элементарной реакции. Она связана с изменением упорядоченности системы при образовании активированного комплекса. Для бимолекулярных реакций эта упорядоченность возрастает, а энергия активации имеет отрицательное значение. Наоборот, для мономолекулярных реакций переходное состояние из-за удлинения рвущихся связей становится менее упорядоченным, и энтропия активации приобретает положительное значение. Рассмотренные представления имеют более важные значения для реакции в газовой фазе.
Для жидкофазных реакций ситуация существенно ускоряется из-за взаимодействия реагентов и активированного комплекса со средой и объединяемых понятием сольватация. Сольватация может быть неспецифической, обусловленной электростатическим взаимодействием реагентов и активированного комплекса с растворителем.
Специфическая сольватация определяется образованием химических связей реагентов и переходного комплекса со средой. В том и другом случае различие сольватации реагентов и активированного комплекса приводят к изменению:
G = k;
Рассмотрим неспецифическую сольватацию:
При взаимодействии между двумя ионами или ионом и нейтральной молекулой в активированном комплексе происходит распределение зарядов:
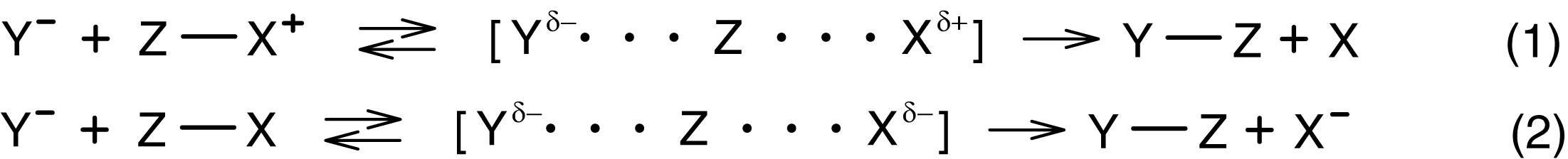
В результате комплекс становится менее способным к электростатической сольватации, чем исходные реагенты. Величина G увеличивается при переходе к более полярным растворителям, а константа скорости уменьшается.
В противоположность этому при взаимодействии двух нейтральных молекул.
![]()
Переходное состояние более полярно и сильно сольватируется, чем исходные реагенты и при повышении диэлектрической постоянной среды константа скорости увеличивается. Графическая зависимость ln k от диэлектрической проницаемости представлена на рис. 10.2.

Рис. 10.2. Влияние диэлектрической проницаемости растворителя на скорость реакции.
воды = 80
метилацетамиа = 200
Специфическая сольватация нередко проявляется сильнее, чем электростатическая и бывает обусловлена главным образом кислотно-основным взаимодействием реагентов с растворителем. Так положительно заряженные ионы обычно сольватированны основаниями (вода, спирты), анионы-молекулами растворителя, способными к образованию водородных связей.
Пример:
![]()
Во втором случае для последней реакции показано, что сольватации подвергаются и нейтральные молекулы содержащие атомы с неподеленной электронной парой электронов.
Пример сольватации катионов:

Если в реагенте происходит разрыв каких либо связей, то его специфическая сольватация может ускорять его реакцию:

В других случаях специфическая сольватация снижает активность реагента из-за рассредоточения заряда или уменьшения электронной плотности на реакционном центре. Этот эффект особенно сказывается на реагентах-анионах.
В качестве примера можно рассмотреть реакцию замещения:
CH3I + Br– CH3Br + I– ;
Эта реакция может ускоряться или замедляться. При сольватации бромид-иона метанола реакция протекает в 5800 раз медленнее, чем в диметилформамиде имеющий ту же диэлектрическую проницаемость.
Примеры элементарных реакций:
Элементарными являются не многие реакции
SN2 – замещение:
![]()
r = k[RCl][Nu-];
E2 – отщепление:

r = k[RC2H4Cl][B–];
Nu– = HO–, RO–, HS–, CN– – нуклеофил;
B– = HO– – основание.
