
- •1. Материальный баланс химических реакций и его характеристика
- •2. Безразмерные характеристики материального баланса
- •3. Концентрация, парциальное давление и мольные доли
- •4. Скорость превращения веществ, скорость реакции и кинетические уравнения
- •5. Экспериментальные установки для кинетических исследований и характеристические уравнения идеальных реакторов
- •6. Идеальный периодический реактор (рпс) и его характеристическое уравнение
- •7. Реактор идеального вытеснения (рив) и его характеристическое уравнение
- •8. Реактор полного идеального смешения (рпс) и его характеристическое уравнение
- •9. Гипотеза о схеме превращений и способы её подтверждения
- •10. Механизм и кинетика элементарных реакций
- •11. Механизм и кинетика сложных реакций
- •12. Основы кинетического исследования
- •13. Интегральный метод обработки опытов по уравнениям с одним неизвестым параметром
- •13.1. Необратимые простые реакции в периодических условиях.
- •13.2. Необратимые простые реакции в условиях идеального вытеснения.
- •13.3 Обратимые реакции в интегральных условиях.
- •14. Дифференциальный метод обработки для простых и обратимых реакций
- •15. Интегральные методы исследования параллельных реакций
- •15.1. Параллельные необратимые реакции одинакового порядка
- •15.2. Метод конкурирующих реакций
- •16. Интегральные методы исследования последовательных реакций
- •17. Исследование влияния температуры
- •18. Удельная производительность реакторов и их сочетаний
- •18.1. Реакторы ипр
- •18.2. Непрерывно-действующие реакторы
- •18.3. Реакторы идеального вытеснения
- •18.4.Реакторы полного смешения
- •18.5. Секционированные реакторы и каскады реакторов
- •18.6. Сочетания реакторов
- •19. Оптимизация процессов
- •19.1.Последовательные необратимые реакции:
- •19.2. Последовательно-параллельные реакции
- •20. Влияние типа реакторов и способа введения реагентов на селективность процесса
- •21. Экономические критерии и их применение для оптимизации процесса
- •Вопросы для контроля
- •Теория химико-технологических процессов органических веществ
- •625000, Тюмень, ул. Володарского, 38.
- •6 25039, Тюмень, ул. Киевская, 52.
4. Скорость превращения веществ, скорость реакции и кинетические уравнения
Кинетический метод является универсальным для количественного изучения химических реакций. Кинетический метод используется в двух направлениях:
Теоретическом – для выяснения механизмов реакции и реакционной способности реагентов.
Практическом – для расчетов химических реакторов и оптимизации химических процессов.
4.1. Периодические реакции. Скорость превращения любого вещества для гомогенных реакций определяется уравнением:
![]() ;
(4-1)
;
(4-1)
ni – количество вещества (моль; кмоль);
t – время (с; мин; ч);
V – объем (мл; л; м3);
![]()
При постоянстве реакционного объема объем можно ввести под знак дифференциала. Тогда получим концентрационное выражение скорости превращения вещества i:
![]() ;
(4-2)
;
(4-2)
Для гетерогенных реакций скорость превращения вещества обычно относят к единице массы катализатора:
![]() ;
(4-3)
;
(4-3)
mК – масса катализатора.
![]()
4.2. Непрерывные процессы. Для непрерывных процессов в стационарных условиях скорость превращения веществ определяется, как производная их мольных потоков по реакционному объему для гомогенных реакций или по массе катализатора для гетерогенно – каталитических реакций
![]() ; (4-4)
; (4-4)
![]() ; (4-5)
; (4-5)
Поскольку Fi измеряют в молях (кмолях)/время, то размерность этих скоростей совпадет с размерностью ri в уравнениях (4-2) и (4-3).
Для любой реакции справедливо соотношение (1-1), которое можно записать в дифференциальной форме:
![]() ;
;
![]() ;
;
Разделим эти равенства на значение Vdt, dt, dV, или dmК, то получим:
![]() ; (4-6)
; (4-6)
В отличии от скорости превращения вещества ri величина r независима относительно участников реакции и всегда положительна . Это и есть скорость химической реакции связанная со скоростью превращения вещества для простых реакций соотношением:
ri = νi·r;
Для сложной системы превращений, каждая из простых реакций имеет некоторую скорость rj:
![]() ;
(4-7) - для гомогенных реакций
;
(4-7) - для гомогенных реакций
![]() ;
(4-8) - для гетерогенных
;
(4-8) - для гетерогенных
i,j стехиометрический коэффициент вещества i для простой реакции j взятый с соответствующим знаком.
Из выражений (4-7) и (4-8) видно, что скорости реакции есть соответствующие производные полноты реакции. В сложных системах реакции каждое вещество может образовываться или расходоваться по нескольким простым реакциям, и тогда общая скорость его превращения будет связана со скоростью соответствующих реакций уравнением:
![]() ; (4-9)
; (4-9)
Это выражение аналогично выражению (1-3).
Для описания дифференциального баланса системы нужно иметь такие уравнения только для ключевых веществ, однако в правой части уравнений нужно учитывать все простые реакций, а не только независимые, как это было при расчете баланса сложных реакций:
Пример:
Процесс гетерогенно-каталитической дегидратации этилового спирта протекает по реакции:
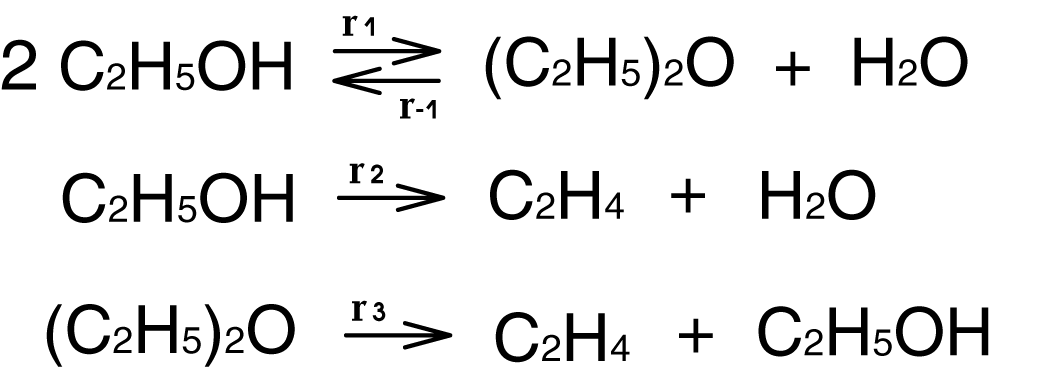
Требуется через скорости реакций записать скорость превращения ключевых веществ. В этой системе реакции имеется 2 ключевых вещества: диэтиловый эфир и этилен. Скорости превращения равны:
![]() ;
;
![]() ;
;
Скорость каждой простой реакции есть функция концентраций или парциальных давлений некоторых постоянных, к которым относятся константы скорости kj, константы равновесия Кj и адсорбционный коэффициент bi.
Константа скорости определяется уравнением Аррениуса:
![]() ; (4-10)
; (4-10)
kj,0 – предэкспоненциальный множитель;
E – энергия активации реакции;
Константы равновесия Кj определяется уравнением
![]() ; (4-11)
; (4-11)
K0 – предэкспоненциальный множитель;
Таким образом константы кинетического уравнения зависят от температуры.
Различные постоянные этого уравнения (kj, Kj, Ej, bj, ki,0 и др.) называют параметрами химической реакции и обозначают через j.
В отличии от этого внешние факторы, влияющие на скорость реакции, можно назвать параметрами химического процесса. Сюда относятся концентрация или парциальное давление, температура. Тогда выражение для скорости реакции можно записать в общем виде:
![]() ; (4-12)
; (4-12)
Концентрационный вид этого уравнения может быть самым разнообразным, являясь следствием механизма реакций, материального баланса веществ и т.д.
Объединяем уравнения (4-9) и (4-12) получаем уравнение для скорости превращения вещества:
![]() ; (4-13)
; (4-13)
В дифференциальной форме уравнение (4-13) описывается изменением количества вещества в зависимости от параметров реакций и условий процесса.
Совокупность уравнения скорости для всех ключевых веществ называют кинетической моделью процесса в стационарных условиях его проведения. Нахождение таких уравнений является задачами кинетического исследования. Основными этапами этого исследования являются:
проведение эксперимента.
выдвижение гипотезы о механизме реакций и построение уравнений на основе этого механизма.
обработка результатов эксперимента по этим уравнениям.
В действительности этапы последовательности нарушаются.
