
- •1. Материальный баланс химических реакций и его характеристика
- •2. Безразмерные характеристики материального баланса
- •3. Концентрация, парциальное давление и мольные доли
- •4. Скорость превращения веществ, скорость реакции и кинетические уравнения
- •5. Экспериментальные установки для кинетических исследований и характеристические уравнения идеальных реакторов
- •6. Идеальный периодический реактор (рпс) и его характеристическое уравнение
- •7. Реактор идеального вытеснения (рив) и его характеристическое уравнение
- •8. Реактор полного идеального смешения (рпс) и его характеристическое уравнение
- •9. Гипотеза о схеме превращений и способы её подтверждения
- •10. Механизм и кинетика элементарных реакций
- •11. Механизм и кинетика сложных реакций
- •12. Основы кинетического исследования
- •13. Интегральный метод обработки опытов по уравнениям с одним неизвестым параметром
- •13.1. Необратимые простые реакции в периодических условиях.
- •13.2. Необратимые простые реакции в условиях идеального вытеснения.
- •13.3 Обратимые реакции в интегральных условиях.
- •14. Дифференциальный метод обработки для простых и обратимых реакций
- •15. Интегральные методы исследования параллельных реакций
- •15.1. Параллельные необратимые реакции одинакового порядка
- •15.2. Метод конкурирующих реакций
- •16. Интегральные методы исследования последовательных реакций
- •17. Исследование влияния температуры
- •18. Удельная производительность реакторов и их сочетаний
- •18.1. Реакторы ипр
- •18.2. Непрерывно-действующие реакторы
- •18.3. Реакторы идеального вытеснения
- •18.4.Реакторы полного смешения
- •18.5. Секционированные реакторы и каскады реакторов
- •18.6. Сочетания реакторов
- •19. Оптимизация процессов
- •19.1.Последовательные необратимые реакции:
- •19.2. Последовательно-параллельные реакции
- •20. Влияние типа реакторов и способа введения реагентов на селективность процесса
- •21. Экономические критерии и их применение для оптимизации процесса
- •Вопросы для контроля
- •Теория химико-технологических процессов органических веществ
- •625000, Тюмень, ул. Володарского, 38.
- •6 25039, Тюмень, ул. Киевская, 52.
16. Интегральные методы исследования последовательных реакций
Из необратимых реакций этого типа наиболее интересны реакции первого порядка:
A0
![]() A1
A1
![]() A2
A2
![]() …;
…;
и последовательно-параллельные превращения, имеющие общий второй реагент:
A0
![]() A1
A1
![]() A2
A2
![]() …;
…;
К последовательно-параллельным реакциям относятся и реакции последовательного замещения атомов водорода при хлорировании, алкилировании и т.д:
![]()
Сюда же относят реакции последовательного присоединения к полиолефинам и ароматическим соединениям:
CH2=CH–CH=CH2
![]() CH3–CH=CH–CH3
CH3–CH–CH–CH3
CH3–CH=CH–CH3
CH3–CH–CH–CH3
Последовательное удлинение молекулярной цепи при олигомеризации:

Рассмотрим кинетику последовательно-параллельных превращений имеющий общий второй реагент:
A0
![]() A1
A1
![]() A2
A2
![]() …;
…;
Если стехиометрические коэффициенты и порядок реакции по реагентам каждой стадии для этой реакции равны единице, то при их необратимости получим для первого промежуточного продукта, что селективность равна:
![]() ;
(16-1)
;
(16-1)
где СА и СВ – текущие концентрации исходного реагента и первого промежуточного продукта.
Последнее выражение надо проинтегрировать. Для этого вводим вспомогательную переменную.
U = C1/C0;
C1 = UC0;
Интегрируем С1 относительно С0:
![]() ;
;
Приравняем правые части последнего уравнения и уравнения (16-1):
![]() ;
;
Из последнего равенства получаем:
![]() ;
;
Опустим минус для удобства, а потом его учтем. Проинтегрируем правую часть уравнения приняв в ней, что (k1/k0) 1 =
Тогда:

![]() ;
;
![]() ;
;
Избавимся от логарифма:
![]() ;
;
Возведем левую и правую части уравнения в степень (k1/k0) 1:
 ;
;
 ;
;
 ;
;
Умножим обе части уравнения на (С0/С0,0)
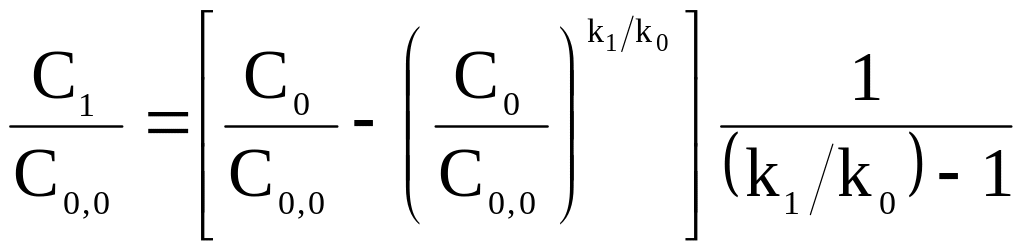 ;
(16-2)
;
(16-2)
Заменим (С0/С0,0)
на (1 – Х0)
и (С1/С0,0)
на
![]() :
:
![]() ;
(16-3)
;
(16-3)
 ;
(16-4)
;
(16-4)
Таким образом, выход первого промежуточного продукта зависит от доли непревращенного исходного реагента или от (1ХА) и от соотношения констант скорости соответствующих реакций. Это уравнение справедливо если (k1/k0) 1.
Если (k1/k0) =1, то справедливо другое выражение. Последовательно- параллельные реакции имеют некоторые важные особенности. Для них часто бывает, что второй реагент вначале превращается в активную промежуточную частицу (радикал или катион), которая атакует каждый из последующих образующих продуктов реакции. Причем эта элементарная стадия и определяет соотношение продуктов. В результате независимо от вида кинетического уравнения реакций оказываются справедливыми выведенные выше уравнения. Проиллюстрируем эти уравнения рис. 16.1

Рис.16.1. Зависимость состава продуктов и селективности последовательных реакций от степени конверсии.
Анализ полученной
зависимости показывает, что по первому
промежуточному продукту при ХА
0, селективность
![]() ,
что является доказательством
последовательной схемы превращения.
,
что является доказательством
последовательной схемы превращения.
17. Исследование влияния температуры
Влияние температуры на состав продукта, селективность и скорость реакции проявляется через зависимость от нее параметров реакций, т.е констант скоростей, равновесия, адсорбционных коэффициентов, коэффициентов диффузии.
Уравнение зависимости константы скорости от температуры:
![]() ;
;
Зависимость константы равновесия от температуры:
![]() ;
;
Зависимость абсорбционных коэффициентов от температуры:
![]() ;
;
В этих реакциях величины kj,0; Kj,0; bi,0 – предэкспоненциальные множители
Kj,0 и bi,0 – постоянные интегрирования, не имеющие физического смысла.
Для полной характеристики процесса при его исследовании необходимо найти предэкспоненциальные множители, энергию активации или энтальпии всех параметров, входящих в кинетическую модель. Последовательность исследований следующая:
1. В начале описанными выше методами при некой температуре находят концентрационные зависимости скорости и ее константы.
2. Считая, что модель сохраняет свой вид и при других температурах, проводят опыты при 2-х – 4-х других температурах, определяя соответствующие параметры.
3. После нахождения констант при нескольких температурах находят активационные параметры или энтальпию процесса по линеаризованной форме приведенных выше уравнений типа Аррениуса:
![]() ;
;
![]() ;
(17.1)
;
(17.1)
![]() ;
;
Эти уравнения в координатах (lnkj,0 1/T) ; (lnKj,0 1/T) ; (lnbi,T 1/T) дают линейную зависимость с тангенсом угла наклона Ej/R, Hj/R (рис.17.1)
Расчет значений lnkj,0; lnKj,0; lnbi,0 проводят при помощи линейного МНК.

Рис.17.1. Линеаризация уравнения Аррениуса.
Доверительный интервал искомых величин находят обычным образом, устраняя в них лишние значащие цифры из предэкспоненциального множителя в уравнении Аррениуса, затем можно найти энергию активации.
