
Структура и стереохимия
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешную координационную сферу.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы. Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой — между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счёт неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы.
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава.
Наиболее типичными комплексообразователями являются катионы d-элементов. Лигандами могут быть:
а) полярные молекулы — NH3, Н2О, CO, NO; б) простые ионы — F−, Cl−, Br−, I−, H+; в) сложные ионы — CN−, SCN−, NO2−, OH−.
Для описания взаимосвязи пространственного строения комплексных соединений и их физико-химических свойства используются представления стереохимии. Стереохимический подход — удобный прием представления свойств вещества в части влияния того или иного фрагмента структуры вещества на свойство.
Объекты стереохимии — комплексные соединения, органические вещества, высокомолекулярные синтетические и природные соединения. А. Вернер, один из основоположников координационной химии, приложил большие усилия к развитию неорганической стереохимии. Именно стереохимия является центральной в этой теории, до сих пор остающийся ориентиром в координационной химии.
Диссоциация — в химии может использоваться в двух смыслах:
разделение молекулярных комплексов на два или больше молекулярных элементов (примерами являются унимолекулярный гетеролизис (см. en:Heterolysis), гомолизис (см. en:Homolysis) и разделение пары ионов на свободные ионы);
разделение элементов любой совокупности на молекулярные элементы. В обоих смыслах диссоциация обратна по смыслу ассоциации. [1]
Если процесс диссоциации обратимый и равновесный, то он может быть описан константой диссоциации, которая для равновесия
![]()
определяется как
![]()
Константы нестойкости
Если вместо равновесия в реакциях образования комплексов рассматривать обратный процесс – реакции диссоциации комплексов (или реакции обмена лигандов на молекулы растворителя), то соответствующие константы будут носить название ступенчатых констант нестойкости комплексов:
[ML]
![]() M
+ L; K1(нест)
= [M] [L] / [ML]
M
+ L; K1(нест)
= [M] [L] / [ML]
[ML2] [ML] + L ; K2(нест) = [ML] [L] / [ML2]
…….
[MLn] [ML(n1)] + L; Kn(нест) = [ML(n1)] [L] / [MLn];
и общих (суммарных) констант нестойкости комплексов:
[ML] M + L; 1(нест) = [M] [L] / [ML]
[ML2] M + 2 L; 2(нест) = [M] [L]2 / [ML2]
[ML3] M + 3 L; 3(нест) = [M] [L]3 / [ML3]
…….
[MLn] M + n L; n(нест) = [M] [L]n / [MLn]
Ступенчатые и общие константы образования и нестойкости комплексов соотносятся друг с другом как обратные величины:
n(обр) = 1 / n(нест); Kn(обр) = 1 / Kn(нест),
поэтому для сравнения прочности комплексов могут использоваться справочные данные как по значениям констант образования, так и констант нестойкости.
Ступенчатое комплексообразование можно проиллюстрировать примером взаимодействия иона Hg2+ (как комплексообразователя) с ионами Cl (как лигандом):
Hg2+ + Cl [HgCl]+; K1(обр) = 1,85 . 105
[HgCl]+ + Cl [HgCl2]; K2(обр) = 3,2 . 107
[HgCl2] + Cl [HgCl3] ; K3(обр) = 14
[HgCl3] + Cl [HgCl4]2 ; K4(обр) = 10
Чем больше концентрация хлоридных ионов, тем с большим координационным числом образуется комплексное соединение. Как только будет достигнуто максимально возможное для данного комплексообразователя координационное число, образование новых комплексных соединений приостанавливается, и при дальнейшем увеличении концентрации лиганда наблюдается постепенное исчезновение в растворе комплексных частиц с меньшими координационными числами.
Из
рис. 2 видно, что уже при концентрации
хлорид-ионов, равной 1 .
105
моль/л, в растворе полностью исчезают
катионы Hg2+
и образуются преимущественно нейтральные
частицы [HgCl2].
При концентрации хлорид-ионов около
0,1 моль/л в растворе присутствуют
комплексы [HgCl2],
[HgCl3]
и [HgCl4]2
.

При концентрации ионов Cl свыше 1 моль/л в растворе присутствуют только тетрахлоромеркурат(II)-ионы [HgCl4]2 , которые довольно легко диссоциируют, отщепляя хлоридный лиганд, но обладают достаточно высокой полной константой образования:
4(обр) = K1(обр) K2(обр) K3(обр) K4(обр) = = (1,85 . 105) (3,2 . 107) 14 10 = 8,3 . 1014
Таким образом, полная константа образования дает возможность судить об отсутствии склонности комплекса к полной диссоциации, а ступенчатая константа образования свидетельствует об устойчивости отдельных форм комплексных ионов или нейтральных комплексов.
Как правило, ступенчатые константы образования уменьшаются по мере возрастания числа лигандов. Например, взаимодействие такого комплексообразователя, как ион Cd2+, с молекулами аммиака, выполняющими функции лиганда, протекает поэтапно, с постепенным уменьшением значения ступенчатой константы образования:
Cd2+ + NH3 [Cd(NH3)]2+ ; K1(обр) = 450
[Cd(NH3)]2+ + NH3 [Cd(NH3)2]2+ ; K2(обр) = 126
[Cd(NH3)2]2+ + NH3 [Cd(NH3)3]2+ ; K3(обр) = 27,5
[Cd(NH3)3]2+ + NH3 [Cd(NH3)4]2+ ; K4(обр) = 8,5
[Cd(NH3)4]2+ + NH3 [Cd(NH3)5]2+ ; K5(обр) = 0,47
[Cd(NH3)5]2+ + NH3 [Cd(NH3)6]2+ ; K6(обр) = 0,02
Однако бывают и исключения, например, уже указанные выше хлоридные комплексы ртути(II).
Среди причин закономерного уменьшения значений ступенчатых констант образования с увеличением числа лигандов прежде всего выделяют возрастание пространственных затруднений в размещении вокруг комплексообразователя все большего числа лигандов и электростатическое отталкивание одноименно заряженных лигандов.
13. Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
где
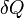 —
подведённое
к телу количество теплоты, измеренное
в джоулях
—
подведённое
к телу количество теплоты, измеренное
в джоулях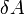 [1] —
работа,
совершаемая телом против внешних сил,
измеренная в джоулях
[1] —
работа,
совершаемая телом против внешних сил,
измеренная в джоулях
Эта формула является математическим выражением первого начала термодинамики
Для квазистатических процессов выполняется следующее соотношение:
![]()
где
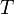 —
температура,
измеренная в кельвинах
—
температура,
измеренная в кельвинах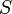 —
энтропия,
измеренная в джоулях/кельвин
—
энтропия,
измеренная в джоулях/кельвин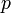 —
давление,
измеренное в паскалях
—
давление,
измеренное в паскалях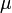 —
химический
потенциал
—
химический
потенциал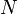 —
количество
частиц в системе
—
количество
частиц в системе
1-й закон — первое начало термодинамики: система есть совокупность веществ взаимодействующих между собой и изолированных от внешней среды.
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
14.2-й закон — второе начало термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе. Это явление называют рассеиванием или диссипацией энергии.
Приведем
второе начало термодинамики в ещё одной
формулировке Рудольфа
Юлиуса Клаузиуса
(1865): для любой квазиравновесной
термодинамической системы существует
однозначная функция термодинамического
состояния
![]() ,
называемая энтропией, такая, что ее
полный дифференциал
,
называемая энтропией, такая, что ее
полный дифференциал
![]() .
[3]
.
[3]
Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
Энтропи́я (от др.-греч. ἐντροπία - поворот, превращение) — в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
