
- •Методи визначення атомних і молекулярних мас.
- •2. Якісна та кількісна інформація, що вміщується в хімічній формулі та хімічному рівнянні.
- •3. Хімічні формули: емпіричні, структурні, молекулярні.
- •4. Основні положення атомно-молекулярного вчення.
- •5. Валентність і ступінь окиснення, чим відрізняються ці поняття? Навести приклади.
- •6. Закон збереження маси та енергії.
- •7. Закон постійності складу. Дальтоніди і бертоліди.
- •8. Закон кратних відношень.
- •9. Газові закони: об’ємних відношень; парціальних тисків Дальтона; Гей-Люссака. Рівняння Клапейрона-Менделєєва.
- •10. Закон Авогадро, висновки з нього. Відносна густина газів.
- •11. Основні газові закони. Приведення об’єму газу до нормальних умов, рівняння Менделєєва-Клапейрона. Числове значення універсальної газової сталої (r) в різних системах.
- •12. Закон Авогадро. Мольний об’єм газу. Число Авогадро. Розрахунок абсолютних мас атомів і молекул. Показати на прикладі сірки і азоту.
- •13. Основні закони хімії: закон збереження маси, закон сталості складу і його сучасне трактування, закон Авогадро.
- •14. Закон Авогадро і наслідки з нього. Відносна густина газів. Застосування цієї величини для визначення молекулярних мас.
- •22. Закон еквівалентів. Методи визначення еквівалентних мас.
- •23. Еквівалент речовини. Закон еквівалентів, його формулювання та математичний вираз.
- •24. Поняття про еквівалент. Розрахунок еквівалента простих речовин, основ і оксидів.
- •25. Формулювання закону еквівалентів. Його розрахунок для кислот,солей і речовин, що беруть участь в окисно-відновних реакціях.
- •29. Опишіть модель атома, запропоновану Резерфордом, і скажіть, чому вона суперечила уявленням класичної фізики.
- •30. Сформулюйте постулати Бора і дайте їм математичну інтерпретацію.
- •31. Який фізичний зміст постійної Рідберга, її величина, розмірність? в якому рівнянні вона використовується?
- •32. Рівняння де Бройля. Чому дуалістична природа характерна для мікросвіту?
- •33. Рівняння Шредінгера. Який фізичний зміст має хвильова функція?
24. Поняття про еквівалент. Розрахунок еквівалента простих речовин, основ і оксидів.
Хімічний еквівалент 1/z*x1 – частинка або частка частинки, яка в даній реакції відповідає (рівноцінна) одному атому (іону) гідрогену або одному електрону, що вона віддає чи приєднує.
Еквівалент простої речовини
![]()
де n(Э) – число атомів елемента (індекс в хімічній формулі)
В(Э) – валентність елемента
Еквівалент основи
![]()
де n(ОH–) – число відданих у ході реакції гідроксид-іонів (кислотність основи)
Еквівалент оксиду
де n(Э) – число атомів елемента (індекс в хімічній формулі)
В(Э) – валентність елемента
25. Формулювання закону еквівалентів. Його розрахунок для кислот,солей і речовин, що беруть участь в окисно-відновних реакціях.
Закон еквівалентів (Д. Дальтон): «Маси речовин, що вступили в хімічну реакцію, прямо пропорційні молярним масам їх хімічних еквівалентів».
Еквівалент кислот
![]()
де n(H+) – число відданих у ході реакції іонів водню (основність кислоти)
Еквівалент солі
![]()
де n(Ме) – число атомів металу (індекс в хімічній формулі солі)
В(Ме) – валентність металу
n(А) – число кислотних залишків
В(А) – валентність кислотного залишку
Еквівалент речовин, що беруть
участь в окисно-відновних реакціях
![]()
де![]() – число електронів, що приймають участь
в процесі окиснення чи відновлення
– число електронів, що приймають участь
в процесі окиснення чи відновлення
29. Опишіть модель атома, запропоновану Резерфордом, і скажіть, чому вона суперечила уявленням класичної фізики.
Розсіювання окремих α-частинок на великі кути Резерфорд пояснив тим, що позитивний заряд в атомі не розподілений рівномірно в кулі радіусом 10-10м, як припускали раніше, а зосереджений в центральній частині атома (атомному ядрі) в області значно менших розмірів. Розрахунки Резерфорда показали, що для пояснення дослідів з розсіювання α-частинок потрібно прийняти радіус атомного ядра рівним приблизно 10-15м.
Резерфорд припустив, що атом влаштований подібно планетарній системі. Як навколо Сонця на великих відстанях від нього обертаються планети, так електрони в атомі обертаються навколо атомного ядра. Радіус кругової орбіти самого далекого від ядра електрона і є радіус атома. Така модель атома була названа планетарною моделлю.
Планетарна модель атома пояснює основні закономірності розсіювання заряджених частинок.
Так як більша частина простору в атомі між атомним ядром і обертаючимися навколо нього електронами порожня, швидко заряджені частинки можуть майже вільно проникати через досить значні шари речовини, що містять кілька тисяч шарів атомів.
При зіткненнях з окремими електронами швидкі заряджені частинки зазнають розсіювання на дуже великі кути, так як маса електрона мала. Однак у тих рідкісних випадках, коли швидка заряджена частинка пролітає на дуже близькій відстані від одного з атомних ядер, під дією сили електричного поля атомного ядра може відбутися розсіювання зарядженої частинки на будь-який кут до 180 °.
30. Сформулюйте постулати Бора і дайте їм математичну інтерпретацію.
Постулати Бора — сформульовані датським фізиком Нільсом Бором основні положення будови атома, що враховують квантовий характер енергії, випромінюваної електронами.
Атомна система може перебувати тільки в особливих стаціонарних, або квантових станах, кожному з яких відповідає певна енергія
 . У стаціонарному стані атом енергію
не випромінює.
. У стаціонарному стані атом енергію
не випромінює.Радіуси
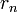 стаціонарних станів задовольняють
умову:
стаціонарних станів задовольняють
умову:
![]()
де![]() - маса електрона,
- маса електрона,
![]() -
зведена стала Планка.
-
зведена стала Планка.
Перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, енергію яких
 визначають за формулою:
визначають за формулою:
![]()
де
![]() і
і
![]() - цілі числа (номери стаціонарних
станів), якщо
- цілі числа (номери стаціонарних
станів), якщо
![]() фотон з частотою
фотон з частотою
![]() випромінюється, якщо
випромінюється, якщо
![]() - поглинається.
- поглинається.
Поглинаючи світло, атом переходить із стаціонарного стану з меншою енергією в стаціонарний стан з більшою енергією. Усі стаціонарні стани, крім одного, є умовно стаціонарними. Нескінченно довго кожен атом може знаходитись лише в стаціонарному стані з мінімальним запасом енергії. Цей стан атома називається основним, всі інші - збудженими.
