
- •1.Развитие представлений о строении атома.
- •2.Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3. Принципы заполнения орбиталей
- •4. Химическая связь: виды, причины образования, основные характеристики
- •5.Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6.Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
- •8. Водородная связь. Межмолекулярные взаимодействия.
- •9.Агрегатные состояния вещества.
- •Газообразное состояние
- •10. Кристаллические вещества. Типы кристаллических решеток. Основные характеристики элементарной кристаллической ячейки. Кристаллические вещества
- •11. Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12.Атомные нарушения структуры кристалла. Классификация дефектов структуры
- •4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
- •4.2. Линейные деффекты (дислокации)
- •13.Термодинамическме системы и параметры. Основные понятия.
- •14.Первое начало термодинамики.
- •15. Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16. Второе начало термодинамики. Энтропия.
- •17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18. Обратимые и необратимые химические реакции. Константа химического равновесия.
- •Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
- •19. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие
- •Гетерогенное химическое равновесие
- •20. Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •Поскольку температура редко изменяется ровно на 10с обычно используют более удобное математическое выражение:
- •2) Образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •Образование конечных продуктов и регенерация катализатора:
- •1. Диффузия исходных веществ к поверхности катализатора.
- •6. Отвод продуктов от поверхности катализатора путем диффузии.
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •4) Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •46. Электролиз. Потенциал разложения. Поляризация.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •Химическая поляризация возникает при использовании инертных электродов.
- •47. Применение электролиза в технике.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Классификация коррозионных процессов
- •49. Механизмы коррозии.
Сравнительная характеристика ммо и мвс
МВС и ММО – квантово-механические методы описания химической связи. Для них характерны следующие общие черты:
Оба метода являются приближенными.
Они приводят к сходному результату для одних и тех же молекул.
Оба метода трактуют связь как результат обобществления электронной плотности связывающих электронов между ядрами.
- и -связи отличаются друг от друга как по характеру перекрывания электронных облаков, так и по свойствам симметрии.
Отличия:
Метод МО более общий и универсальный, обладает более совершенным математическим аппаратом и используется чаще в количественных расчетах. Его представление о полностью делокализованных молекулярных орбиталях, охватывающих все ядра системы, прогрессивны и физически адекватны.
ММО придает преувеличенное значение делокализации электрона в молекуле и основывается на одноэлектронных волновых функциях – молекулярных орбиталях.
Магнетизм и окраска вещества также легко объясняются ММО.
Метод ВС привлекателен своей наглядностью и простотой интерпритации, однако его представление о сохранении атомами практически полной индивидуальности не учитывает реального положения дел в молекуле.
МВС преувеличивает роль локализации электронной плотности и основывается на том, что элементарная связь осуществляется только парой электронов между двумя атомами.
Таким образом, МВС и ММО не исключают один другого, а взаимно дополняют. МВС более нагляден, а ММО более строг количественно.
Количественные расчеты в ММО, несмотря на свою громоздкость, все же гораздо проще, чем в МВС. Поэтому в настоящее время в квантовой химии МВС почти не применяется. В то же время качественно выводы МВС гораздо нагляднее и шире используются экспериментаторами, чем ММО. Основанием для этого служит тот факт, что реально в молекуле вероятность пребывания данного электрона между связанными атомами гораздо больше, чем на других атомах, хотя и там она не равна нулю. В конечном счете, выбор метода определяется объектом исследования и поставленной задачей.
Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
Ионы
- это заряженные
частицы, в которые превращаются атомы
в результате отдачи или присоединения
электронов. Na:
1s2
2s2
2p6
3s1
F:
1s2
2s2
2p5
![]()
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью.
Если атом теряет один или несколько электронов, то он превращается в положительный ион - катион (в переводе с греческого - "идущий вниз). Так образуются катионы водорода Н+, лития Li+, бария Ва2+. Приобретая электроны, атомы превращаются в отрицательные ионы - анионы (от греческого "анион" - идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
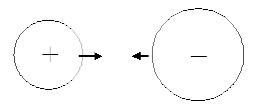
Для возникновения ионной связи необходимо, чтобы сумма значений энергии ионизации Ei (для образования катиона) и сродства к электрону Ae (для образования аниона) должна быть энергетически выгодной. Это ограничивает образование ионной связи атомами активных металлов (элементы IA- и IIA-групп, некоторые элементы IIIA-группы и некоторые переходные элементы) и активных неметаллов (галогены, халькогены, азот).
Теоретически можно представить крайний случай, когда область перекрывания электронных облаков полностью смещена к одному из ядер. Такую связь называют ионной. Вещества с чисто ионной связью не известны.
Правильнее было бы называть ионную связь сильно полярной, полного перехода одного электрона к другому атому не наблюдается; в самых «ионных» веществах доля ионности связи не превышает 90%.
Поляризация – смещение электронной плотности эл. заряда под действием эл. поля.
Поляризуемость - это способность молекул (атомов или ионов) поляризоваться (т.е. становиться полярными или более полярными)под влиянием внешнего электрического поля (или под влиянием поля, создаваемого приблизившейся полярной молекулой). В молекуле каждый из ионов поляризуется под влиянием заряда другого иона. В результате возникает индуцированный наведённый диполь μ1 и μ2, направленный противоположно дипольному моменту молекулы, создаваемому ионами
Na+ Cℓ- μ=q * ℓ μопыт.= μ - (μ1 + μ2) Вследствие поляризации ионов произойдёт перераспределение электронной плотности и дипольный момент молекулы понизится. Расчётное значение μ(NaCℓ) =3,06.10-29Кл.м, что близко к опытному. Например: CsF обладает 90% - ионной связи и 10% - ковалентной полярной связью
LiH 80% 20% NaCℓ 80% 20%
Как правило ионные связи очень прочные, их энергия приблизительно равна энергии ковалентной связи. Основные свойства ионной связи:
1) вещества в твёрдом состоянии – кристаллы;
2) обладают более высокой температурой кипения и плавления, чем соединения с ков. связью;
3) обладают электропроводностью в расплавленном состоянии (NaCℓ);
4) имеют склонность растворяться в полярных растворителях (Н2О).
Металлическая связь - Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому в кристаллической решетке металла эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. "Обобществленные" электроны передвигаются в пространстве между катионами и удерживают их вместе. Межатомные расстояния в металлах больше, чем в их соединениях с ковалентной связью. Такая связь существует не только в твердых кристаллах металлов, но и в расплавах и в аморфном состоянии. Она называется металлической.

Металлическая связь - химическая связь, обусловленная наличием большого количества не связанных с ядрами подвижных электронов.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из “электронного газа”. Как следствие этого, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. В случае металлов невозможно говорить о направленности связей, так как валентные электроны распределены по кристаллу почти равномерно. Именно этим и объясняется, например, пластичность металлов, т. е. возможность смещения ионов и атомов в любом направлении без нарушения связи.
В кристаллах металлов атомы ионизированы не полностью, и часть валентных электронов остается связанной. В результате возможно появление частично ковалентных связей между соседними атомами. Вклады ионной и ковалентной составляющей обнаружены во многих металлах. Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связи. Важнейшим признаком металлов считают высокую электропроводность, которая уменьшается с ростом температуры. Электроны в металле беспорядочно движутся, переходя от одного атома к другому. А положительно заряженные ионы лишь слегка колеблются около своего положения в кристаллической решетке. Благодаря наличию свободных, не связанных с определенными атомами электронов, металлы хорошо проводят электрический ток и тепло. При нагревании металла колебания катионов усиливаются. Электронам труднее продвигаться между ними, поэтому электрическое сопротивление металла увеличивается.
Наличие свободных электронов обусловливают высокую теплопроводность металлов и характерный металлический блеск. Их высокая пластичность и ковкость связаны с возможностью взаимного смещения катионов в металлической кристаллической решетке без разрыва химической связи. Донорно-акцепторная связь.
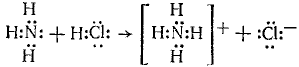
Донорно-акцепторная связь (координационная связь, семиполярная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Донорно-акцепторная связь образуется часто при комплексообразовании за счет свободной пары электронов, принадлежавшей (до образования связи) только одному атому (донору). Донорно-акцепторная связь отличается от обычной ковалентной только происхождением связевых электронов. Реакция аммиака с кислотой состоит в присоединении протона, отдаваемого кислотой, к неподеленным электронам азота:
В ионе NH4+ все четыре связи азота с водородом равноценны, хотя отличаются происхождением. Донорами могут быть атомы азота, кислорода, фосфора, серы и др. Роль акцепторов могут выполнять протон, а также атомы с незаполненным октетом, напр. атомы элементов III группы таблицы Д. И. Менделеева, а также атомы-комплексообразователи, имеющие незаполненные энергетические ячейки в валентном электронном слое. Донорно-акцепторная связь называется иначе семиполярной (полуполярной), так как на атоме-доноре возникает эффективный положительный заряд, а на атоме-акцепторе — эффективный отрицательный заряд. Изображают эту связь стрелкой, направленной от донора к акцептору. См. также Ковалентная связь.
