
- •1.Развитие представлений о строении атома.
- •2.Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3. Принципы заполнения орбиталей
- •4. Химическая связь: виды, причины образования, основные характеристики
- •5.Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6.Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
- •8. Водородная связь. Межмолекулярные взаимодействия.
- •9.Агрегатные состояния вещества.
- •Газообразное состояние
- •10. Кристаллические вещества. Типы кристаллических решеток. Основные характеристики элементарной кристаллической ячейки. Кристаллические вещества
- •11. Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12.Атомные нарушения структуры кристалла. Классификация дефектов структуры
- •4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
- •4.2. Линейные деффекты (дислокации)
- •13.Термодинамическме системы и параметры. Основные понятия.
- •14.Первое начало термодинамики.
- •15. Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16. Второе начало термодинамики. Энтропия.
- •17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18. Обратимые и необратимые химические реакции. Константа химического равновесия.
- •Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
- •19. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие
- •Гетерогенное химическое равновесие
- •20. Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •Поскольку температура редко изменяется ровно на 10с обычно используют более удобное математическое выражение:
- •2) Образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •Образование конечных продуктов и регенерация катализатора:
- •1. Диффузия исходных веществ к поверхности катализатора.
- •6. Отвод продуктов от поверхности катализатора путем диффузии.
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •4) Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •46. Электролиз. Потенциал разложения. Поляризация.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •Химическая поляризация возникает при использовании инертных электродов.
- •47. Применение электролиза в технике.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Классификация коррозионных процессов
- •49. Механизмы коррозии.
46. Электролиз. Потенциал разложения. Поляризация.
В принципе процесс электролиза обратен процессам работы соответствующих ГЭ, но имеются и существенные различия. При электролизе сила тока, а следовательно и количество вещества, подвергнутого электролизу в единицу времени зависит от разности потенциалов, наложенной на электроды (Е). Повышая эту разность потенциалов, мы увеличиваем силу тока и, соответственно, увеличиваем скорость э/х реакции. Однако для того чтобы данный процесс электролиза мог быть практически осуществимым, приложенная к электродам разность потенциалов должна быть не менее некоторой, определенной характерной для данного процесса величины. Эта наименьшая разность потенциалов, необходимая для данного процесса электролиза называется потенциалом разложения (или напряжением разложения) электролита.
Изменение потенциала электродов при прохождении электрического тока называется поляризацией или перенапряжением. Термин перенапряжение обычно употребляется, когда известна причина изменения потенциала.
Например: при каждом выделении водорода мы говорим о водородном перенапряжении, а при анодном выделении кислорода – кислородном перенапряжении. Эти два вида имеют особое практическое значение.
При наличии поляризации, потенциал катода движется в сторону более электроотрицательных значений, а потенциал анода – в сторону более положительных. В результате общая разность потенциалов становится больше, чем теоретическое значение, рассчитанное по равновесным потенциалам:поляр = i - равн ,где i - потенциал электрода при прохождении тока; равн – равновесный потенциал (I = 0).
Так как поляризация наблюдается и на катоде (Кt) и на аноде (Аn), то различают анодную и катодную поляризацию.
Величина поляризации электродов зависит от следующих факторов:
Природы материала электрода
Природы электролита (т.е. химическая природа ионов, которые разряжаются на электродах) Состояния поверхности электродов
 Согласно
закону Фарадея, скорость э/х реакции
пропорциональна силе тока (I),
но так как электроды могут быть различными
по площади, то в зависимости от площади
электрода при одном и том же потенциале
могут быть разные токи. Поэтому скорость
э/х реакции относят к единице площади
поверхности:
Согласно
закону Фарадея, скорость э/х реакции
пропорциональна силе тока (I),
но так как электроды могут быть различными
по площади, то в зависимости от площади
электрода при одном и том же потенциале
могут быть разные токи. Поэтому скорость
э/х реакции относят к единице площади
поверхности:
 ,
где i
– плотность тока.
,
где i
– плотность тока.
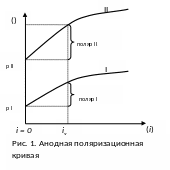
Графическая зависимость потенциала электрода () от плотности тока (i) называют поляризационной кривой = f(i).
Величина поляризации определяется из разности между потенциалами при прохождении тока (i ) и равновесным потенциалом (р ) при i = 0:пол = i - равн
Из рисунка видно, что при одной и той же плотности тока (iх), поляризация второго электрода больше, чем у первого. Следовательно при использовании второго электрода процесс станет более энергоёмким. Из кривых следует, что для увеличения скорости э/х реакции следует повысить скорость тока или поляризацию. Во многих случаях явление поляризации нежелательно, так как оно приводит к повышенному расходу электроэнергии. Скорость и механизм э/х реакции изучает электрохимическая кинетика. В отличие от химических процессов, на скорость э/х реакции кроме Т, Р, С элемента, природы электролита, природы электродов, большое влияние оказывает потенциал.
Любая э/х реакция протекает как минимум в 3 стадии:
