
- •1.Развитие представлений о строении атома.
- •2.Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3. Принципы заполнения орбиталей
- •4. Химическая связь: виды, причины образования, основные характеристики
- •5.Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6.Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
- •8. Водородная связь. Межмолекулярные взаимодействия.
- •9.Агрегатные состояния вещества.
- •Газообразное состояние
- •10. Кристаллические вещества. Типы кристаллических решеток. Основные характеристики элементарной кристаллической ячейки. Кристаллические вещества
- •11. Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12.Атомные нарушения структуры кристалла. Классификация дефектов структуры
- •4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
- •4.2. Линейные деффекты (дислокации)
- •13.Термодинамическме системы и параметры. Основные понятия.
- •14.Первое начало термодинамики.
- •15. Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16. Второе начало термодинамики. Энтропия.
- •17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18. Обратимые и необратимые химические реакции. Константа химического равновесия.
- •Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
- •19. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие
- •Гетерогенное химическое равновесие
- •20. Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •Поскольку температура редко изменяется ровно на 10с обычно используют более удобное математическое выражение:
- •2) Образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •Образование конечных продуктов и регенерация катализатора:
- •1. Диффузия исходных веществ к поверхности катализатора.
- •6. Отвод продуктов от поверхности катализатора путем диффузии.
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •4) Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •46. Электролиз. Потенциал разложения. Поляризация.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •Химическая поляризация возникает при использовании инертных электродов.
- •47. Применение электролиза в технике.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Классификация коррозионных процессов
- •49. Механизмы коррозии.
4. Химическая связь: виды, причины образования, основные характеристики
Химическая связь – взаимодействие атомов, обуславливающая устойчивость химической частицы или кристалла как целого. Химическая связь образуется за счёт электростатического взаимодействия между заряженными частицами (катионы, анионы, ядро).
1861 год, А.М. Бутлеров выдвинул теорию химического строения:
Атомы в молекуле соединены друг с другом в определенной последовательности, её изменения приводят к новому веществу с новыми свойствами.
Соединения атомов происходят в соответствии с их валентностью.
Свойства веществ зависят не только от их состава, но и от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, связанные между собой.
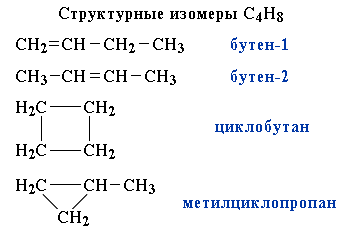
Эта теория объясняла теорию изометрии. Пример изомерии
При взаимодействии атомов между ними может возникнуть химическая связь. Чем она прочнее, тем больше энергии нужно затратить для ее разрыва, поэтому энергия разрыва связи служит мерой ее прочности. Следовательно, при образовании химической связи энергия всегда выделяется за счет уменьшения потенциальной энергии взаимодействующих электронов и ядер. Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов. Характеристики химической связи:
1. Энергия связи. Основной причиной образования молекул из атомов является выигрыш энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. Химическая связь возникнет лишь в том случае, если в результате нового распределения электронов потенциальная энергия молекулы окажется ниже суммы энергий отдельных атомов. Следовательно, при образовании химической связи (молекулы) энергия выделяется – это количество энергии называется энергией связи (Э.С.).
Энергия связи — это работа, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Чаще всего энергию связи измеряют в кДж/моль. Наиболее прочными являются ионные и ковалентные связи, энергии этих связей составляют величины от десятков до сотен кДж/моль. Металлическая связь, как правило, несколько слабее ионных и ковалентных связей, но величины энергий связи в металлах близки к значениям энергии ионных и ковалентных связей. Об этом свидетельствуют, в частности, высокие температуры кипения металлов, например 357 °С (Hg), 880 °С (Na), 3000 0С (Fe) и т. д. Энергии водородных связей очень небольшие по сравнению с энергией межатомных связей. Так, энергия водородной связи составляет обычно величину 20—40 кДж/моль.
Чем выше энергия химической связи, тем прочнее связь. Связь считается прочной, или сильной, если ее энергия превышает 500 кДж/моль (например, 942 кДж/моль для N2), слабой - если ее энергия меньше 100 кДж/моль (например, 69 кДж/моль для NO2). Если при взаимодействии атомов выделяется энергия менее 15 кДж/моль, то считают, что химическая связь не образуется, а наблюдается межмолекулярное взаимодействие (например, 2 кДж/моль для Xe2.
Энергия химических связей - это энергия, которую необходимо затратить для разрыва химических связей. При этом из молекулы образуются атомы, радикалы, ионы или возбужденные молекулы.
2. Длина связи - расстояние между центрами двух атомов, которое соответствует максимально потерянной потенциальной энергии, и сложная частица является наиболее прочной. Таким образом, длина связи тесно связана с энергией. Длина связи определяется расстоянием между ядрами связанных атомов в молекуле. Как правило, длина химической связи меньше, чем сумма радиусов атомов, за счет перекрывания электронных облаков.
В зависимости от типа связи, ближайшего окружения, длина связи может значительно изменяться. Длина связи обусловлена размерами реагирующих атомов и степенью перекрывания их электронных облаков.
Например: в водородных соединениях галогенов – галоген водородах, длина связи изменяется следующим образом: H – F H – Cl H – Br H – J
Длина связи, нм 0,092 0,128 0,142 0,162
так как по мере возрастания порядкового номера увеличивается радиус соответствующего атома галогена и длина химической связи увеличивается.
Для
атома водорода длина связи составляет
0,74 .
![]()
Это
означает, что 2 атома Н2
не просто соприкасаются, а частично
перекрываются.
Область перекрытия показывает место нахождения общей электронной пары и называется областью повышенной электрической плотности.
Химическая связь обычно изображается черточками, соединяющими взаимодействующие атомы; каждая черта эквивалентна обобщенной паре электронов. В соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию.
Валентный угол — угол между воображаемыми линиями, проходящими через центры химически связанных атомов.
Например, показано, что молекулы состава AB2 могут быть линейными (CO2) или угловыми (H2O), AB3 - треугольными (BF3) и пирамидальными (NH3), AB4 — тетраэдрическими (CH4), или квадратными (PtCl4)-, или пирамидальными (SbCl4)-, AB5 - тригонально-бипирамидальными (PCl5), или тетрагонально-пирамидальными (BrF5), AB6 — октаэдрическими (AlF6)3- и т.д.
Валентные углы закономерно изменяются с изменением порядкового номера в периодической таблице. Например, угол H-Э-H для H2O, H2S, H2Se уменьшается (104,5; 92 и 900 ,соответственно).
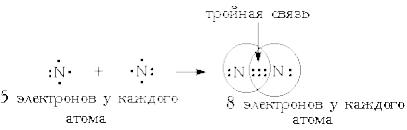
Кратность связи –число электронных пар, посредством которых осуществляется химическая связь между атомами.
Различают связи различной кратности между одними и теми же атомами. Одинарная связь всегда слабее, чем кратные связи - двойная и тройная - между теми же атомами.
Ординарная связь образуется одной электронной парой, причем электронная плотность в основном сосредоточена между атомами на оси связи (сигма-связь) Вторая связь, образованная второй электронной парой, должна располагаться вне линии связи, так как понятие орбиталь включает в себя и пространство, в котором движется электрон, а благодаря принципу исключения Паули на ней не может быть более 2-х электронов с противоположными спинами. Очевидно, что количество связей между двумя атомами не может быть большим — обычно не более 3-х. Кроме того, можно заключить, что вторая связь слабее первой, так как ее протяженность больше, а электронная плотность — меньше. Однако суммарная энергия кратной связи больше, чем ординарной. Длина же кратной связи уменьшается с увеличением ее кратности. Виды Химической связи:
1. Ковалентная 2.Ионная 3.Металлическая 4.Межмолекулярная
