
- •1.Развитие представлений о строении атома.
- •2.Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3. Принципы заполнения орбиталей
- •4. Химическая связь: виды, причины образования, основные характеристики
- •5.Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6.Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
- •8. Водородная связь. Межмолекулярные взаимодействия.
- •9.Агрегатные состояния вещества.
- •Газообразное состояние
- •10. Кристаллические вещества. Типы кристаллических решеток. Основные характеристики элементарной кристаллической ячейки. Кристаллические вещества
- •11. Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12.Атомные нарушения структуры кристалла. Классификация дефектов структуры
- •4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
- •4.2. Линейные деффекты (дислокации)
- •13.Термодинамическме системы и параметры. Основные понятия.
- •14.Первое начало термодинамики.
- •15. Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16. Второе начало термодинамики. Энтропия.
- •17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18. Обратимые и необратимые химические реакции. Константа химического равновесия.
- •Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
- •19. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие
- •Гетерогенное химическое равновесие
- •20. Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •Поскольку температура редко изменяется ровно на 10с обычно используют более удобное математическое выражение:
- •2) Образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •Образование конечных продуктов и регенерация катализатора:
- •1. Диффузия исходных веществ к поверхности катализатора.
- •6. Отвод продуктов от поверхности катализатора путем диффузии.
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •4) Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •46. Электролиз. Потенциал разложения. Поляризация.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •Химическая поляризация возникает при использовании инертных электродов.
- •47. Применение электролиза в технике.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Классификация коррозионных процессов
- •49. Механизмы коррозии.
24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
Теория активных столкновений (ТАС)
Эта теория базируется на двух общих положениях:
Реакция осуществляется в момент столкновения двух молекул А и В;
Столкновение молекул приводит к химическому превращению только в том случае, когда молекулы А и В обладают достаточно большим запасом энергии. Эта энергия необходима для преодоления действия сил отталкивания, проявляющихся при сближении любых валентно-насыщенных молекул. Если относительная скорость движения молекул А и В (вдоль линии, соединяющей центры) достаточно велика, молекулы могут сблизиться до таких малых расстояний, на которых возможно перераспределения химических связей в реагентах.
Следовательно, эффективны не все столкновения, а только те в которых участвуют энергетически подготовленные „активированные частицы“, энергия которых должна превышать некоторое критическое значение (Eкр). Число активированных частиц составляет лишь часть от общего числа частиц в системе и пропорциональна фактору Больцмана:
 N
N
T1
T2 T2 > T1
Eакт
Еср Екр Е
избыточное количество энергии по сравнению со средней величиной энергии системы.
При низких температурах фактор Больцмана мал и число активированных частиц (Nакт) настолько мало, что реакция практически не происходит. При T кривая распределения Максвелла смещается, и число Nакт становится достаточным для заметного химического превращения. Рост Nакт при повышении Т системы носит экспоненциальный характер. Как видно, подавляющее число частиц системы находится в стабильном состоянии. Столкновения таких частиц носят упругий характер, т.е. без каких-либо изменений их строения. При сообщении таким частицам некоторой порции энергии в них происходит (наряду с увеличением интенсивности теплового движения) ослабление, «разрыхление» внутренних межатомных связей.
Способы активации молекул обычно подразделяются на термические и нетермические. При термическом характере активация происходит за счет обмена энергий в результате столкновения молекул, имеющих достаточно высокие энергии, т. е. активных молекул. Реакции с нетермическим характером активации рассматриваются в специальных разделах физической химии. К ним относятся реакции:
а) под действием излучения (фотохимия);
б) в электрических разрядах или плазме (газовая электрохимия или химия плазмы);
в) под действием частиц радиоактивного распада или рентгеновского излучения (радиохимия).
Частицы активируются, т.е. «приводятся в готовность» к перестройке внутренней структуры – к химическому превращению. Следовательно, энергия, необходимая для перевода частиц 1 моля вещества из стабильного состояния в активированное, называется энергией активации ЕА. Ее величина является тем фактором, посредством которого сказывается влияние природы реагирующих веществ.
Если ЕА <40 кДж/моль, то это означает, что значительная часть столкновений между частицами приводит к реакции.
Если ЕА >120 кДж/моль, то это означает, что очень малая часть столкновений между частицами приводит к реакции.
Наглядное представление об энергии активации дает энергетическая диаграмма элементарного акта реакции А+В=АВ
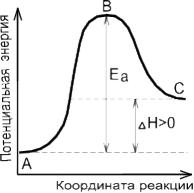
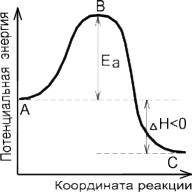
Например, для синтеза йодоводорода: H2+I2=2HIEA=165,5 кДж/моль
Путь процесса на энергетической диаграмме проходит через энергетический барьер. Потенциальные энергетические барьеры ограничивают развитие реакции; благодаря этому многие возможные реакции разрешенные термодинамикой задерживаются или практически не протекают. Так дерево, бумага, различные ткани, нефть вполне способны согласно термодинамике окисляться и гореть на воздухе. Причина, по которой они не загораются «сами собой» в обычных условиях, заключается в большой величине энергии активации ( ЕА) соответствующих окислительных реакций. По аналогичной причине азот не реагирует с водой, хотя принципиально такая реакция возможна. Исчезни энергетический барьер, и азот воздуха с водой рек, морей, океанов образовал бы слабую азотную кислоту (НNО3); все живые организмы разрушились бы вследствие беспорядочных реакций гидролиза; запасы организмы разрушились бы вследствие беспорядочных реакций гидролиза; запасы угля воспламенились бы и в мире наступил бы хаос вследствие безудержного развития потока реакции.
Следовательно, чем ниже ЕА , тем больше константа скорости.
Постоянные уравнения Аррениуса имеют большое значение. Физический смысл ЕА мы рассмотрели, теперь разберём физический смысл предэкспоненциального множителя k0.
Для элементарной биомолекулярной реакции А + В = АВ.
где Z0 – общее число столкновений
в 1 см3 в 1 секунду [см3/с]
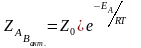 Согласно
теории Аррениуса, каждое столкновение
активных молекул А
и В
должно приводить к образованию продукта
реакции. Число активных столкновений
описывается на основании уравнения
Больцмана:
Согласно
теории Аррениуса, каждое столкновение
активных молекул А
и В
должно приводить к образованию продукта
реакции. Число активных столкновений
описывается на основании уравнения
Больцмана:
 Теория
активных столконовений построена на
использовании результатов, полученных
в кинетической теории газов. Согласно
с молекулярно-кинетической теорией
газов
Теория
активных столконовений построена на
использовании результатов, полученных
в кинетической теории газов. Согласно
с молекулярно-кинетической теорией
газов
где n A и nB – число молекул А и В в 1 см3;
dAB – средний эффективный диаметр при столкновении молекул разного вида (наименьшее расстояние между центрами столкновения молекул)
dAB=rA+rB (= сумме радиусов молекул [см]);
MА и МВ – молекулярные массы А и В соответственно [г/моль]
Подставим выражение Z0 в ZAВакт.
Так как процесс превращения активных реагентов в продукты реакции происходит мгновенно в момент столкновения (согласно теории Аррениуса), то скорость реакции можно выразить через число активных столкновений:
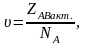
то получим

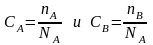 Согласно
закону действующих масс
Согласно
закону действующих масс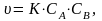
с учётом, что
[моль/см3]
Приравниваем выражения для скорости и получаем:

k0 =const
В уравнении Аррениуса к0 = Z0P, Z0 – частота двойных столкновений – согласно молекулярно-кинетической теории (газов). При столкновении молекул разного сорта.
Член уравнения характеризует долю столкновений А и В, содержащих необходимую для протекания реакции энергию (ЕЕА).
[P] – стерический фактор, определяемый из опыта k0=Z0P- учитывает (характеризует) вероятность определенной геометрической конфигурации частиц при столкновении. Следовательно, чтобы столкнувшиеся активные частицы прореагировали, необходимо чтобы их реакционные способные части были ориентированы определенным образом. Величину Р оценивают путем сопоставления рассчитанной скорости с найденной на опыте:
10-8<P<102 и считается, что если
Р=1 – реакции нормальные k0= 1014
Р<1 – реакции медленные k0= 10-2 – 10-7
Р>1 – реакции быстрые к0>1014
(например для реакции H2 + I2 2HI P=0,1
(более ясное представление о Р дает теория активированного комплекса).
Таким
образом, уравнение Аррениуса имеет вид
![]()
Здесь Z – число всех соударений, P – доля соударений, благоприятных в пространственном отношении (принимает значения от 0 до 10-9)
Например, если сталкиваются атомы водорода и галогена, то небезразлично каким образом они ориентированы по отношению друг к другу. Электронная плотность валентных орбиталей галогена распределена в пространстве сложным образом: на рисунке зачерчены две р-орбитали атома галогена, имеющие по два спаренных электрона и не зачерчена одна р-орбиталь, имеющая 1 электрон.
Н
галоген Р
Для того чтобы образовалась химическая связь атом Н должен осуществить перекрывание электронных облаков именно с орбиталью, имеющей один неспаренный электрон.
Етеор = Еопытное – ½ RT , т.к. для большинства реакций
Е104-105 кал/моль. Для Т<1000 К можно применить Е Еопытное.
Недостатки теории ТАС: несовпадение экспериментально и теоретически рассчитанных величин константы скорости реакции. Причина этого заключается в том, что большинство реакций является результатом не одного столкновения, как предполагает ТАС, а нескольких, т.е. реакция протекает в несколько стадий.
Теория активированного комплекса
Современная теория «абсолютных скоростей» базируется на теории активированного комплекса (ТАК), предложенной Эйрингом в 1935 г. и независимо от него Поляни и Эвансом в 1935 г. были опубликованы работы аналогичного характера, используя понятие «переходного состояния»). ТАС указала принципиально возможный путь абсолютного расчета констант скоростей реакций только на основе элементарных свойств реагирующих веществ: данных об их геометрической конфигурации, размерах и силовых постоянных. В основе теории лежат следующие постулаты (положения):
а) протекание реакции существенно не нарушает распределение молекул по состояниям;
б) движение ядер при элементарном акте реакции подчиняется законам классической механике;
в) исходные вещества находятся в равновесии с активированным комплексом.
Основу ТАК составляет предположение о том, что в ходе химической реакции начальная конфигурация атомов переходит в конечную путем непрерывного изменения межядерных расстояний. При этом всегда существует промежуточная конфигурация атомов, которая является критической для данного процесса. И если система ее достигла, то имеется большая вероятность того, что реакция будет завершена. Критическая конфигурация – это конфигурация из реагирующих атомов или молекул, представляющих промежуточное состояние в элементарном акте химической реакции.
Критическая конфигурация характеризуется повышенным запасом потенциальной энергии, короткой продолжительностью жизни (10-13 с) и наличием особой колебательно-поступательной степени свободы.
Эта критическая конфигурация, имеющая избыток энергии по сравнению с энергией реагирующих частиц, получила название активированного комплекса. Активированный комплекс обозначается формулой, указывающий на его химический состав, и символом справа от формулы.
А+В А-ВАВ Например: Н2+I22НI
Н I H I H I
+
H I H I H I
реагенты активированный комплекс продукт
В активированном комплексе происходит перераспределение электронной плотности между атомами. Связи H-I образуются одновременно с ослаблением (разрывом) связей H-Н и I-I в исходных реагентах.
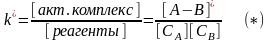 При
установлении равновесия между реагентами
и активированным комплексом имеем:
При
установлении равновесия между реагентами
и активированным комплексом имеем:
Затем активированные комплексы разрушаются, при этом образуются продукты реакции. Скорость разрушения активированных комплексов и, следовательно, образования продуктов исключительно велика, поскольку связи в активированном комплексе неустойчивы. Активированные комплексы подвержены более интенсивным вращениям и колебаниям, чем любые другие молекулы. Когда колебание становится более интенсивным, слишком сильное удлинение соответствующей связи не позволяет атомам восстановить их начальные положения и происходит разрыв связи.
Скорость разрушения активированных комплексов и скорость образования продуктов, т.е. скорость реакции пропорциональна числу активированных комплексов, разрушающихся за единицу времени в единице объема, т.е. концентрации активированных комплексов, умноженного на kT/h, имеющий размерность [с-1], представляет собой как бы частоту распада активированного комплекса. Он одинаков для всех реакций и зависит только от Т. (T=const)
kT/h , где k – постоянная Больцмана; h – постоянная Планка;
Т – абсолютная температура, К.
 Следовательно,
для данной Т
частота распада одинакова для всех
активированных комплексов:
т.е.
при данной Т
константа скорости пропорциональна к
- константе равновесия между реагентами
и активированным комплексом.
Следовательно,
для данной Т
частота распада одинакова для всех
активированных комплексов:
т.е.
при данной Т
константа скорости пропорциональна к
- константе равновесия между реагентами
и активированным комплексом.
 æ
æ
æ
В более общем случае в уравнение нужно ввести добавочный множитель æ (каппа), называемый трансмиссионным коэффициентом или коэффициентом прохождения. Он учитывает долю (æ) активных комплексов, превращающихся в продукты реакции. Для большинства реакций æ близок к 1 (æ1) (и для приближенных расчетов его можно не учитывать. Термодинамика позволяет связать к с энергией Гиббса образования активированного комплекса:
Преимущества теории активированного комплекса (ТАС):
ТАС может быть применима к реакциям протекающим в растворах, тогда как теория столкновений хорошо описывает только реакции в газовой фазе.
