
- •1.Развитие представлений о строении атома.
- •2.Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3. Принципы заполнения орбиталей
- •4. Химическая связь: виды, причины образования, основные характеристики
- •5.Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6.Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
- •8. Водородная связь. Межмолекулярные взаимодействия.
- •9.Агрегатные состояния вещества.
- •Газообразное состояние
- •10. Кристаллические вещества. Типы кристаллических решеток. Основные характеристики элементарной кристаллической ячейки. Кристаллические вещества
- •11. Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12.Атомные нарушения структуры кристалла. Классификация дефектов структуры
- •4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
- •4.2. Линейные деффекты (дислокации)
- •13.Термодинамическме системы и параметры. Основные понятия.
- •14.Первое начало термодинамики.
- •15. Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16. Второе начало термодинамики. Энтропия.
- •17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18. Обратимые и необратимые химические реакции. Константа химического равновесия.
- •Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
- •19. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие
- •Гетерогенное химическое равновесие
- •20. Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •Поскольку температура редко изменяется ровно на 10с обычно используют более удобное математическое выражение:
- •2) Образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •Образование конечных продуктов и регенерация катализатора:
- •1. Диффузия исходных веществ к поверхности катализатора.
- •6. Отвод продуктов от поверхности катализатора путем диффузии.
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •4) Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •46. Электролиз. Потенциал разложения. Поляризация.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •Химическая поляризация возникает при использовании инертных электродов.
- •47. Применение электролиза в технике.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Классификация коррозионных процессов
- •49. Механизмы коррозии.
Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
На практике обычно приходится встречаться с реакциями, протекающими в статистических условиях или в потоке. Реакции в статистических условиях протекают при V=const.
t1
t2
t3
t1
t2
c1
c2
c1
c2
c3
реагент CA
c
t
продукт CВ
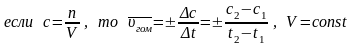 Средняя
скорость
гомогенной реакции, протекающей в
статистических условиях, определяется
как изменение концентрации веществ в
единицу времени:
Средняя
скорость
гомогенной реакции, протекающей в
статистических условиях, определяется
как изменение концентрации веществ в
единицу времени:
Чаще всего концентрацию выражают в моль/л.
Средняя скорость реакции не одинакова в интервале времени t, т.к. концентрации веществ со временем также изменяются.
инетические зависимости для реагентов и продуктов реакции имеют вид:
Односторонняя реакция в статистических условиях:
A B
Чтобы выражение для скорости было всегда положительным, необходимо
в правой части уравнения выбирать знак «+» или «-» в зависимости от того, по изменению какой концентрации (реагента или продукта) выполняется расчет. Поэтому в химической кинетике принято говорить не о скорости химической реакции вообще, а о скорости по некоторому компоненту. В кинетике чаще используется понятие истинной (мгновенной) скорости реакции, которая определяется пределом, к которому стремится выражение С/t при t 0, т.е. изменение концентрации вещества, отнесённое к бесконечно малому промежутку времени.
 В
кинетике чаще используется понятие
истинной
(мгновенной)
скорости
реакции
В
кинетике чаще используется понятие
истинной
(мгновенной)
скорости
реакции
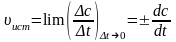
определяется пределом, к которому стремится выражение сt при t0, т.е. изменение концентрации вещества, отнесению к бесконечно малому промежутку времени.
В каждый момент времени скорость реакции равна тангенсу угла наклона кривой с = f(t) в данной точке.
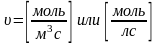
 Гетерогенной
системой называется система,
состоящая из нескольких фаз, отделенных
друг от друга поверхностью раздела.
Гетерогенной
системой называется система,
состоящая из нескольких фаз, отделенных
друг от друга поверхностью раздела.
Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
В гетерогенных системах реакция протекает только на поверхности раздела фаз, образующих систему. Например, растворение Ме в кислоте:Fe + 2HCl = FeCl2 + H2.
Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
где S – площадь поверхности раздела фаз.
Скорость химической реакции служит важнейшей количественной характеристикой химического взаимодействия – различные реакции идут с разными скоростями. Например, процессы разложения взрывчатых веществ протекают практически мгновенно, другие реакции продолжаются минуты, часы, сутки, превращения в земной коре длятся тысячи и миллионы лет.
Скорость реакции также может значительно меняться в зависимости от условий ее протекания, и, как правило, со временем уменьшается. Однако известны автокаталитические и цепные реакции, скорости которых с течением времени увеличиваются. Можно создать и такие условия, при которых скорость реакции будет оставаться постоянной.
Элементарными (простыми) называют реакции, идущие в одну стадию. Их принято классифицировать по молекулярности.
.Число молекул (частиц), одновременным взаимодействием которых осуществляется акт химического превращения, называется молекулярностью.
Мономолекулярные – реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):I2 I• + I•
Бимолекулярные – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):СН3Вr + КОН СН3ОН + КВr
Тримолекулярные – реакции, элементарный акт которых осуществляется при столкновении трех частиц:О2 + NО + NО 2NО2
Реакции с молекулярностью более трех неизвестны.
Закон действующих масс (ЗДМ): при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в соответствующих степенях. Математическую форму записи зависимости c называют кинетическим уравнением. В общем виде для реакции 1А + 2В + 3С+ … продукты
 данное
выражение иногда называют основным
постулатом химической кинетики,
где:
данное
выражение иногда называют основным
постулатом химической кинетики,
где:
k – константа скорости (коэффициент пропорциональности);
CА, CВ, CС – концентрации исходных реагентов;
ni – порядок реакции по данному веществу (частный порядок реакции определяется экспериментально);
Физический смысл k (коэффициента пропорциональности) можно установить, если принять все концентрации равными 1 (СА, СВ, СС = 1). При этом условии =k. Другими словами, константа скорости химической реакции есть скорость реакции при условии, что концентрации реагирующих веществ равны 1,
т.е. k зависит от природы реагирующих веществ,
температуры,
катализатора,
но не зависит от концентрации реагирующих веществ.
Для сравнения скоростей используют именно k. Константа скорости является основной величиной в химической кинетике, чем больше k процесса, тем больше скорость. Для разных реакций величина k может изменяться в весьма широких пределах. Например, для обычных реакций органического синтеза k 10 , а для реакций нейтрализации (одного из самых быстрых химических процессов) k 1011.
В тех случаях когда реакция протекает в одну стадию (такая реакция называется элементарной химической реакцией) порядок реакции ni по данному веществу (степень в законе действия масс) совпадает со стехиометрическим коэффициентом данного вещества в уравнении реакции.
Например,
для одностадийной элементарной реакции
закон действия масс запишется следующим
образом
Кинетический порядок элементарной реакции равен ее молекулярности. Для реакции второго порядка n=2, а для реакции первого порядка n=1 и т. д. Однако чаще всего химические реакции не протекают в одну стадию, как их принято записывать в учебниках химии. В обычной одностадийной записи уравнений химической реакции указывается только начальное и конечное состояние системы, что является по существу символическим выражением материального баланса (закона сохранения вещества).
Огромное количество химических реакций является совокупностью последовательных или же параллельно протекающих элементарных реакций, каждая из которых может принадлежать к любой кинетической группе. Это осложняет изучение кинетики процесса в целом. Например, реакцию окисления ионов Fe2+ молекулярным кислородом в кислом растворе записывают обычно в виде: 4Fe2+ + 4H+ + O2 4Fe3+ + 2H2O
Но этот процесс таким образом осуществляться не может, поскольку соударение одновременно девяти исходных частиц является событием маловероятным и, кроме того, восемь исходных частиц заряжены положительно и должны отталкиваться друг от друга. По современным представлениям, процесс окисления Fe2+ (II) идет через 7 стадий, в которых участвуют ионы, молекулы и свободные радикалы. Радикалами называются частицы, имеющие один или несколько неспаренных электронов{H, N, O, Cl, Na и др.}, а также многоатомные частицы, в состав которых входит атом с неспаренным р-электроном. Продолжительность существования радикалов обычно исчисляется долями секунды.
 Приведенный
сложный путь реакции – более вероятен
и, следовательно, более осуществим, т.к.
в каждой стадии сталкиваются только 2
частицы и ни в одной из них не происходит
соударения одноимённо заряженных
частиц.
Приведенный
сложный путь реакции – более вероятен
и, следовательно, более осуществим, т.к.
в каждой стадии сталкиваются только 2
частицы и ни в одной из них не происходит
соударения одноимённо заряженных
частиц.
Второй пример: образование воды при горении водорода в кислороде 2Н2+О22Н2О протекает через 18 элементарных стадий.
Рассмотрим простейшую сложную реакцию: 2HI+H2O2 I2+2H2O согласно уравнению в этой реакции участвуют 3 молекулы, но проведенный эксперимент показывает, что эта реакции второго порядка. Изучение механизма позволяет установить, что она протекает в 2 последовательные стадии:НI+H2O2HIO+H2O (медленная стадия) (1) HIO –иодноватистая кислота
HIO+НI I2+H2O (быстрая стадия) (2)2HI+H2O2I2+2H2O
Скорость стадии (2) настолько велика, что измерить ее не удается. В то же время экспериментально суммарный порядок медленной элементарной стадии (1) оказывается равным 2. Именно эта медленная бимолекулярная реакция характеризует скорость сложной реакции. Такая стадия называется лимитирующей стадией. Выявление лимитирующей стадии в сложной многостадийной реакции – одна из важнейших задач химической кинетики.
21. Факторы, влияющие на скорость химической реакции.
23. Зависимость скорости реакции от температуры. Уравнение Аррениуса. Энергия активации.
Скорость химической реакции зависит от следующих факторов:
Природы реагирующих веществ. Концентрации (Закон действующих масс).
Температуры (Правило Вант-Гоффа, уравнение Аррениуса). Катализатора.
1. Зависимость скорости от природы реагирующих веществ
Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.
