
- •1.Развитие представлений о строении атома.
- •2.Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3. Принципы заполнения орбиталей
- •4. Химическая связь: виды, причины образования, основные характеристики
- •5.Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6.Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
- •8. Водородная связь. Межмолекулярные взаимодействия.
- •9.Агрегатные состояния вещества.
- •Газообразное состояние
- •10. Кристаллические вещества. Типы кристаллических решеток. Основные характеристики элементарной кристаллической ячейки. Кристаллические вещества
- •11. Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12.Атомные нарушения структуры кристалла. Классификация дефектов структуры
- •4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
- •4.2. Линейные деффекты (дислокации)
- •13.Термодинамическме системы и параметры. Основные понятия.
- •14.Первое начало термодинамики.
- •15. Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16. Второе начало термодинамики. Энтропия.
- •17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18. Обратимые и необратимые химические реакции. Константа химического равновесия.
- •Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
- •19. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие
- •Гетерогенное химическое равновесие
- •20. Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •Поскольку температура редко изменяется ровно на 10с обычно используют более удобное математическое выражение:
- •2) Образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •Образование конечных продуктов и регенерация катализатора:
- •1. Диффузия исходных веществ к поверхности катализатора.
- •6. Отвод продуктов от поверхности катализатора путем диффузии.
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •4) Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •46. Электролиз. Потенциал разложения. Поляризация.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •Химическая поляризация возникает при использовании инертных электродов.
- •47. Применение электролиза в технике.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Классификация коррозионных процессов
- •49. Механизмы коррозии.
18. Обратимые и необратимые химические реакции. Константа химического равновесия.
Различают кинетически обратимые и необратимые химические реакции.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании: 2KClO3 = t0 2KCl + 3O2 ↑
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Рассмотрим признаки необратимости химических реакций:
Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
а) соединения удаляющегося из сферы реакции, - малорастворимого вещества, выпадающего в осадок, и (или) газ, улетучивающегося из реакционной смеси;
ВаСl2 + Н2SО4 = ВаSО4↓ + 2НСl Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
б) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
2) Реакция сопровождается большим выделением энергии, например горение магния:
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства (=) или стрелка ().
Необратимыми являются реакции нейтрализации, комплексообразования, термического разложения сложных веществ, взаимодействия активных металлов с кислородом, водой и кислотами и др.
Для необратимых реакций, а их в природе большинство, чем обратимых, в принципе, можно подобрать условия, при которых они будут протекать обратимо.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны ().
Примером такой реакции может служить синтез аммиака из водорода и азота:
3Н2 + N2 2NH3 ∆H = -92 кДж / моль
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Понятие обратимой реакции не соответствует термодинамическому понятию «обратимый процесс».
Константа химического равновесия
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные давления P или мольные доли X реагирующих веществ. Для некоторой реакции
![]() соответствующие
константы равновесия выражаются
следующим образом:
соответствующие
константы равновесия выражаются
следующим образом:
![]() (1)
(1) ![]() (2)
(2)![]() (3)
(3)
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры, но не зависит от их концентрации. Выражение для константы равновесия для элементарной обратимой реакции может быть выведено из кинетических представлений.
Уравнения (1-3) представляют собой варианты закона действующих масс (ЗДМ) для обратимых реакций в состоянии равновесия. При постоянной температуре отношение равновесных концентраций (парциальных давлений) конечных продуктов к равновесным концентрациям (парциальным давлениям) исходных реагентов, возведенных соответственно в степени, равные их стехиометрическим коэффициентам, величина постоянная (К. Гульдберг, П. Вааге, 1867 г.).
На основании уравнения состояния идеального газа, записанного в виде соотношения Pi = CiRT, где Сi = ni/V, и закона Дальтона для идеальной газовой смеси, выраженного уравнением P = ΣPi , можно вывести соотношения между парциальным давлением Pi, молярной концентрацией Сi и мольной долей Xi i-го компонента:
![]() (4)
Отсюда получаем соотношение между Kc,
Kp
и Kx:
(4)
Отсюда получаем соотношение между Kc,
Kp
и Kx:
![]() (5)
Здесь Δν
– изменение числа молей газообразных
веществ в течение реакции: Δν
= – ν1
– ν2
– ... + ν'1
+ ν'2
+ ...
(5)
Здесь Δν
– изменение числа молей газообразных
веществ в течение реакции: Δν
= – ν1
– ν2
– ... + ν'1
+ ν'2
+ ...
Величина константы равновесия Kx, в отличие от констант равновесия Kc и Kp, зависит от общего давления Р.
Рассмотрим процесс установления равновесия в системе, в которой в начальный момент времени присутствуют только исходные вещества А и В. Скорость прямой реакции 1 в этот момент максимальна, а скорость обратной 2 равна нулю:

 (6)
(6)
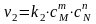
(7)
По мере уменьшения концентрации исходных веществ растет концентрация продуктов реакции; соответственно, скорость прямой реакции уменьшается, скорость обратной реакции увеличивается. Очевидно, что через некоторое время скорости прямой и обратной реакции сравняются, после чего концентрации реагирующих веществ перестанут изменяться, т.е. установится химическое равновесие.
Приняв,
что 1
= 2,
можно записать:![]() (8)
(8)![]() (9)
(9)
Т.о., константа равновесия (Кс) есть отношение констант скорости прямой и обратной реакции.
Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
Чем больше величина К, тем больше числитель дроби, т.е. тем больше концентрация образующихся веществ и, следовательно, тем больше выход продуктов реакции.
Если 0 < K < 1 – то процесс убыточный;
Если 1 К < 104 – то процесс выгодный;
Если К > 104 – то процесс технологически выгодный.
Найдем связь между энергией Гиббса и константой равновесия. Если система находится в состоянии химического равновесия, то получаем:
![]() (10)
(10) (11)
(11)
Здесь рi – равновесные парциальные давления исходных веществ и продуктов реакции. Уравнение (10) называют изотермой химической реакции.
Влияние внешних условий на химическое равновесие
При постоянстве внешних условий система может находиться в состоянии равновесия сколь угодно долго. Если изменить эти условия (т.е. оказать на систему какое-либо внешнее воздействие), равновесие нарушается; в системе возникает самопроизвольный процесс, который продолжается до тех пор, пока система опять не достигнет состояния равновесия (уже при новых условиях). Рассмотрим, как влияют на положение равновесия некоторые факторы.
Влияние концентраций.
1.
В систему
добавлено исходное вещество.
В этом случае![]() ;
; ![]() ;
;
ΔG < 0. В системе возникнет самопроизвольный химический процесс, направленный в сторону расходования исходных веществ и образования продуктов реакции (химическое равновесие смещается вправо), т.е. в сторону конечных продуктов.
2.
В систему
добавлен продукт реакции.
В этом случае![]() ;
; ![]() ;
;
ΔG > 0. Химическое равновесие будет смещено влево (в сторону расходования продуктов реакции и образования исходных веществ).
Поясним
это правило на примере реакции синтеза
аммиака,
протекающей по уравнению:

Если увеличить концентрацию N2(г) и H2(г), то равновесие сместиться вправо, ибо прямая реакция приведет к уменьшению концентрации исходных веществ.
Влияние давления.
Парциальные давления всех компонентов Рi в этом случае изменяются в одинаковой степени; направление смещения равновесия будет определяться суммой стехиометрических коэффициентов Δn (Δn = Σ(ni)прод – Σ(ni)исх).
Учитывая, что парциальное давление газа в смеси равно общему давлению, умноженному на мольную долю компонента в смеси (Рi = РХi),
Примем, что Р2 > Р1. В этом случае, если Δn > 0 (реакция идет с увеличением числа молей газообразных веществ), то ΔG > 0; равновесие смещается влево. Если реакция идет с уменьшением числа молей газообразных веществ (Δn < 0), то ΔG < 0; равновесие смещается вправо. Иначе говоря, увеличение общего давления смещает равновесие в сторону процесса, идущего с уменьшением числа молей газообразных веществ.
Уменьшение общего давления газов в смеси (Р2 < Р1) будет смещать равновесие в сторону реакции, идущей с увеличением числа молей газообразных веществ.
Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия.
Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия.
В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
Необходимо отметить, что изменение концентрации или давления, смещая равновесие, не изменяет величину константы равновесия, которая зависит только от природы реагирующих веществ и температуры.
Влияние температуры.
Повышение либо понижение температуры означает приобретение либо потерю системой энергии и, следовательно, должно изменять величину константы равновесия.
Запишем уравнение нахождения энергии Гиббса в двух видах и приравняем их, при этом получим:
![]() (12)
(12)![]() (13)
(13)
Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры.
Экзотермические реакции: ΔH° < 0 (ΔU° < 0). Повышение температуры уменьшает величину константы равновесия, т.е. смещает равновесие влево.
Эндотермические реакции: ΔH° > 0 (ΔU° > 0). Повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
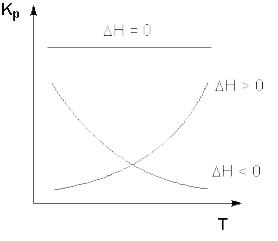
Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
Графики зависимостей константы равновесия от температуры для экзотермических и эндотермических реакций приведены на рис. 2.
Рис. 2. Зависимость константы равновесия от температуры.
