
- •1.Развитие представлений о строении атома.
- •2.Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3. Принципы заполнения орбиталей
- •4. Химическая связь: виды, причины образования, основные характеристики
- •5.Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6.Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
- •8. Водородная связь. Межмолекулярные взаимодействия.
- •9.Агрегатные состояния вещества.
- •Газообразное состояние
- •10. Кристаллические вещества. Типы кристаллических решеток. Основные характеристики элементарной кристаллической ячейки. Кристаллические вещества
- •11. Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12.Атомные нарушения структуры кристалла. Классификация дефектов структуры
- •4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
- •4.2. Линейные деффекты (дислокации)
- •13.Термодинамическме системы и параметры. Основные понятия.
- •14.Первое начало термодинамики.
- •15. Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16. Второе начало термодинамики. Энтропия.
- •17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18. Обратимые и необратимые химические реакции. Константа химического равновесия.
- •Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
- •19. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие
- •Гетерогенное химическое равновесие
- •20. Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •Поскольку температура редко изменяется ровно на 10с обычно используют более удобное математическое выражение:
- •2) Образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •Образование конечных продуктов и регенерация катализатора:
- •1. Диффузия исходных веществ к поверхности катализатора.
- •6. Отвод продуктов от поверхности катализатора путем диффузии.
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •4) Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •46. Электролиз. Потенциал разложения. Поляризация.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •Химическая поляризация возникает при использовании инертных электродов.
- •47. Применение электролиза в технике.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Классификация коррозионных процессов
- •49. Механизмы коррозии.
17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
Все реальные системы неизолированные; подавляющее большинство из них, в том числе аппараты различных отраслей промышленности, являются открытыми. Для подобных систем, только с помощью энтропии нельзя охарактеризовать направление процесса.
Метод термодинамических потенциалов был предложен американским физиком Виллардом Гиббсом ( 1880 г.) и разработан настолько совершенно, что как показали последующие годы, не нуждается ни в каких коррективах.
В термодинамике, так же как и во всех других разделах физики, под потенциалом понимают величину, убыль (уменьшение) которой определяет производимой системой работу.
Однако следует учесть, что в термодинамике работа зависит от пути процесса, поэтому в каждом случае необходимо оговаривать условия проведения процессов для того, чтобы исключить зависимость работы от пути процесса. Кроме того, только в равновесном процессе можно получить максимальную работу и именно с этой работой связывают величину термодинамического потенциала.
Для общего случая обратимых и необратимых процессов можно объединить 1 и 2 законы термодинамики:
Из первого закона термодинамики следует:dQ = dU +dA.
Из второго закона:dQ= TdS,поэтомуTdS = dU + dA. (34)
Неревенство (34) представляет собой обобщенную форму записи первого и второго начал термодинамики.Из (34) следует, что:dA = TdS - dU. (35)
При постоянных Т и V (35) интегрируется непосредственно:AV = T(S2 - S1) - (U2 - U1) Или AV = TS2 -TS1 - U2 + U1,откудаAV = -[( U2 - TS2) - (U1 - TS1)],(36)гдеU - TS = F,поэтому:AV =-( F2 - F1)
F - новая функция состояния, называемая энергией Гельмгольца (свободная энергия при постоянном объеме системы или изохорно-изотермический термодинамический потенциал).
Соотношение (37) читается: “... работа неизолированной системы в условиях V, T = const не более убыли энергии Гельмгольца”.
Величина АР = AV - p есть величина максимальной полезной работы, где АV - максимальная полная работа.
По
аналогии АР
может быть определена в виде разности
двух значений некоторой функции G
- энергии
Гиббса:AР
 -( G2 -
G1)
-( G2 -
G1)
Так же как энтальпия отличается от внутренней энергии на величину pV, так и G отличается от F на величину pV:G = F + pV = U - TS + pV = H - TS. (39)
Итак, окончательно:F = U - TS и G = H - TS, (40)где F и G - новые функции состояния.
ΔG = ΔH – TΔS (41)Измеряется и рассчитывается только изменение энергии Гиббса:
ΔG0298 кДж/моль.
Т.к. ΔH и ΔS имеют сложную температурную зависимость, то для практических вычислений используют формулу приближенного расчета энергии Гиббса:
ΔG0298 = ΔH0298– TΔS0298 (42)
Для простых веществ изменения энергии Гиббса равны нулю. Изменение энергии Гиббса, также как и энтропии, говорит о направлении протекания процесса.
Направление протекания процессов в неизолированных системах и термодинамические условия равновесия.
Полные дифференциалы от F и G:
dF = dU - TdS - SdT и dG = dU - TdS - SdT + pdV + Vdp. (41)
Из соотношения (34):dU TdS - pdV. (42)ТогдаdF = TdS - pdV - TdS - SdT и
dG = TdS - pdV - TdS - SdT + pdV + Vdpи окончательно:
dF = - SdT - pdV и dG - SdT + Vdp. (43)Полученные соотношения (43) показывают, что при V, T = const (изохорно - изотермические условия): dF=0, (44)а при p, T = const (изобарно - изотермические условия):dG=0, (45)
Таким образом в неизолированных системах, находящихся в условиях V, T = const самопроизвольно могут быть реализованы процессы, сопровождающиеся уменьшением энергии Гельмгольца, а в случае р, Т = const - уменьшением энергии Гиббса.
Пределом протекания процессов или состоянием термодинамического равновесия является достижение некоторого минимума этих функций для данных условий:
d(F, G) = 0 и d2(F, G) > 0. (46)
U=const
V=const
dS=0
P=const
T=const
dG=0
V=const
T=const
dF=0
Путь процесса
Путь процесса
Путь процесса
dS>0
dG>0
dG<0

АВ - необратимый самопроизвольный процесс, происходящий в закрытых системах при Р, Т =const, сопровождается убылью энергии Гиббса и завершается достижением равновесия;
ВС - необратимый несамопроизвольный процесс;
В - состояние равновесия – из нее система без внешнего водействия выйти не может, т.к. это соответствует увеличение свободной энергии
При ΔG < 0 реакция термодинамически разрешена и система стремится к достижению условия ΔG = 0, при котором наступает равновесное состояние обратимого процесса; ΔG > 0 указывает на то, что процесс термодинамически запрещен.
Анализ уравнения (34) позволяет установить, какой из факторов, составляющих энергию Гиббса, ответственен за направление протекания химической реакции, энтальпийный (ΔH) или энтропийный (ΔS · T).
Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре.
Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
В остальных случаях (ΔH < 0, ΔS < 0 и ΔH > 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми.
Проиллюстрируем эти четыре случая соответствующими реакциями:
1. |
ΔH < 0 ΔS > 0 ΔG < 0 |
C2H5–O–C2H5 + 6O2 = 4CO2 + 5H2O (реакция возможна при любой температуре) |
2. |
ΔH > 0 ΔS < 0 ΔG > 0 |
реакция невозможна |
3. |
ΔH < 0 ΔS < 0 ΔG > 0, ΔG < 0 |
N2 + 3H2 = 2NH3 (возможна при низкой температуре) |
4. |
ΔH > 0 ΔS > 0 ΔG > 0, ΔG < 0 |
N2O4(г) = 2NO2(г) (возможна при высокой температуре). |
Для
оценки знака ΔG
реакции важно знать величины ΔH
и ΔS
наиболее
типичных процессов. ΔH
образования сложных веществ и ΔH
реакции лежат в пределах 80–800 кДж∙моль-1.
Энтальпия реакции сгорания
 всегда
отрицательна и составляет тысячи
кДж∙моль-1.
Энтальпии фазовых переходов обычно
меньше энтальпий образования и химической
реакции
всегда
отрицательна и составляет тысячи
кДж∙моль-1.
Энтальпии фазовых переходов обычно
меньше энтальпий образования и химической
реакции
 – десятки кДж∙моль-1,
– десятки кДж∙моль-1,
 и
и
 равны 5–25 кДж∙моль-1.
равны 5–25 кДж∙моль-1.
УРАВНЕНИЕ ГИББСА-ГЕМГОЛЬЦА
Функции F и G, как оказалось - надежный критерий оценки возможности, направления и пределов протекания естественных процессов в неизолированных системах. Однако при решении реальных задач возникает необходимость знания зависимости F и G от температуры.
После дифференцирования (40):dF = dU - TdS - SdT,где TdS = dU + pdV.Тогда:
dF = dU - dU - pdV - SdT = -pdV - SdT,из чего:F = f (V, T). (47)
Тогда:
 ,
(48) где
,
(48) где
 =
-p, а
=
-p, а
 =
-S. (49)
=
-S. (49)
Аналогично:dG = dU + pdV + Vdp - TdS - SdT,где TdS = dU + pdV.
Тогда:dG = dU + pdV + Vdp - dU - pdV - SdT = Vdp - SdT,следовательноG = f (p, T). (50)
После
дифференцирования (50): ,откуда
,откуда
 ,
а
,
а
 ,
(51)После
замены из (49) и (51) уравнения (40) примут
вид:
,
(51)После
замены из (49) и (51) уравнения (40) примут
вид: и
и
 (51)
(51)
Получены два важных уравнения, называемые уравнениями Гиббса - Гельмгольца, устанавливающие зависимость F и G, при V и p = const соответственно, от температуры.
Составляя уравнения (51) для исходного и конечного состояния системы и вычитая первые из вторых можно получить соотношения для изменения этих функций:
 и
и
 (52)
(52)
Из
ранее изложенного: ;
;
 ;
;
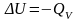 ;
;
 .
.
Поэтому: ,
a
,
a
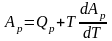 (53)
(53)
или уравнение Гиббса - Гельмгольца в обобщенной форме записи:
 ,
(54)где
,
(54)где
 - температурный коэффициент работы.
- температурный коэффициент работы.
