
- •1.Развитие представлений о строении атома.
- •2.Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3. Принципы заполнения орбиталей
- •4. Химическая связь: виды, причины образования, основные характеристики
- •5.Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6.Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
- •8. Водородная связь. Межмолекулярные взаимодействия.
- •9.Агрегатные состояния вещества.
- •Газообразное состояние
- •10. Кристаллические вещества. Типы кристаллических решеток. Основные характеристики элементарной кристаллической ячейки. Кристаллические вещества
- •11. Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12.Атомные нарушения структуры кристалла. Классификация дефектов структуры
- •4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
- •4.2. Линейные деффекты (дислокации)
- •13.Термодинамическме системы и параметры. Основные понятия.
- •14.Первое начало термодинамики.
- •15. Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16. Второе начало термодинамики. Энтропия.
- •17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18. Обратимые и необратимые химические реакции. Константа химического равновесия.
- •Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
- •19. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие
- •Гетерогенное химическое равновесие
- •20. Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •Поскольку температура редко изменяется ровно на 10с обычно используют более удобное математическое выражение:
- •2) Образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •Образование конечных продуктов и регенерация катализатора:
- •1. Диффузия исходных веществ к поверхности катализатора.
- •6. Отвод продуктов от поверхности катализатора путем диффузии.
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •4) Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •46. Электролиз. Потенциал разложения. Поляризация.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •Химическая поляризация возникает при использовании инертных электродов.
- •47. Применение электролиза в технике.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Классификация коррозионных процессов
- •49. Механизмы коррозии.
4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
Температура. Даже в идеальном при O ºК кристалле с повышением температуры возникают дефекты. Это происходит потому, что повышение температуры способствует перемещению атомов или ионов в промежуточные положения, а также взаимному замещению ионами друг друга в подрешетках кристалла.
Равновесная концентрация вакансий в кристалле растет с повышением температуры по экспоненциальному закону. Подвергая кристалл закалке, т. е. фиксируя при низкой температуре его высокотемпературное состояние, можно создать избыточную концентрацию вакансий в кристалле. Именно из-за этого можно резко изменить механические свойства материала путем закалки. При сильно неравновесных условиях возможно пересыщение кристалла вакансиями, тогда они объединяются и образуют поры, перерастающие иногда в «отрицательные» кристаллы.
Примеси. (примесные дефекты) В узлах решетки часть основных ионов заменена ионами примеси – твердые растворы замещения, или ионы примеси находятся в промежуточных положениях решетки – твердые растворы внедрения. Следовательно наличие тех или иных дефектов в реальных кристаллах определяется условиями их образования. Искажая кристаллическую решетку все виды точечных дефектов влияют на физические свойства (уменьшается пластичность и электропроводность и т.д)
4.2. Линейные деффекты (дислокации)
Линейные дефекты—одномерные, т. е. протяженные в одном измерении: нарушения периодичности в одном измерении простираются на расстояния, сравнимые с размером кристалла, а в двух других измерениях не превышают нескольких параметров решетки.
У линейных дефектов – длина на несколько порядков больше ширины (это так называемые краевые и винтовые дислокация), возникает при пластических деформациях.
К нестабильным линейным дефектам кристалла относятся цепочки точечных дефектов — вакансий или междоузельных атомов; длительно существовать они не могут.
Устойчивыми, стабильными в кристалле являются дислокации.
Априорное представление о дислокациях впервые использовано в 1934 году Орованом и Тейлером при исследовании пластической деформации кристаллических материалов, для объяснения большой разницы между практической и теоретической прочностью металла.
Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей.
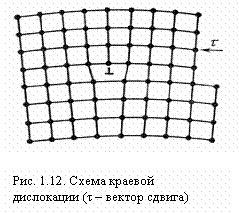
Как отмечено выше, пластическая деформация в кристалле происходит вдоль определенных плоскостей, в определенных направлениях. Распространяется она не мгновенно, а постепенно, т. е. в процессе пластической деформации в каждый момент в кристалле можно обнаружить движущуюся границу между областью, в которой уже прошла пластическая деформация (пластический сдвиг), и областью, где де формации еще нет. Эта граница и есть линия дислокации. Концы этой линии выходят на поверхность кристалла или же она образует внутри кристалла замкнутую дислокационную петлю. В зависимости от того, как расположены участки этой линии по отношению к вектору сдвига, различают краевые и винтовые дислокации.
Краевая и винтовая дислокации
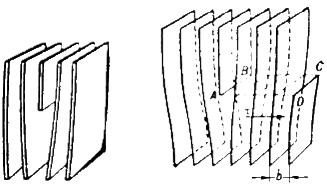
. Краевая дислокация представляет собой линию, вдоль которой обрывается внутри кристалла край “лишней“ полуплоскости.Краевая дислокация напоминает книгу, у которой оторвали часть листа.
Рис. 6. Краевая дислокация (а) и механизм ее образования (б)
Неполная плоскость называется экстраплоскостью.
Большинство дислокаций образуются путем сдвигового механизма. Ее образование можно описать при помощи следующей операции. Надрезать кристалл по плоскости АВСD, сдвинуть нижнюю часть относительно верхней на один период решетки в направлении, перпендикулярном АВ, а затем вновь сблизить атомы на краях разреза внизу.
Наибольшие искажения в расположении атомов в кристалле имеют место вблизи нижнего края экстраплоскости. Вправо и влево от края экстраплоскости эти искажения малы (несколько периодов решетки), а вдоль края экстраплоскости искажения простираются через весь кристалл и могут быть очень велики (тысячи периодов решетки)
Если
экстраплоскость
находится
в
верхней
части
кристалла,
то
краевая
дислокация
–
положительная
(![]() ),
если
в
нижней,
то
–
отрицательная
(
),
если
в
нижней,
то
–
отрицательная
(![]() ).
Дислокации
одного
знака
отталкиваются,
а
противоположные
притягиваются.
).
Дислокации
одного
знака
отталкиваются,
а
противоположные
притягиваются.
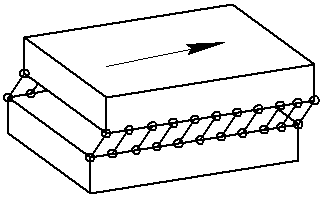
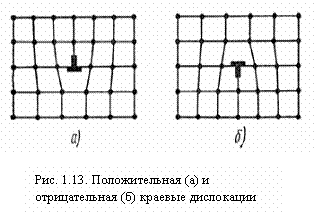
Рис. 7.
Рис. 8.
Краевая дислокация простирается в плоскости скольжения по всему кристаллу в направлении перпендикулярном направлению скольжения.
Другой тип дислокаций был описан Бюргерсом, и получил название винтовая дислокация
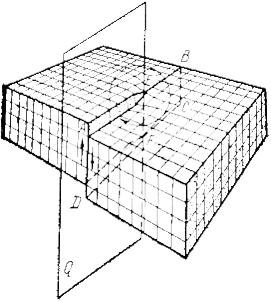
Винтовая дислокация получена при помощи частичного сдвига по плоскости Q вокруг линии EF (рис. 9) На поверхности кристалла образуется ступенька, проходящая от точки Е до края кристалла. Такой частичный сдвиг нарушает параллельность атомных слоев, кристалл превращается в одну атомную плоскость, закрученную по винту в виде полого геликоида вокруг линии EF, которая представляет границу, отделяющую часть плоскости скольжения, где сдвиг уже произошел, от части, где сдвиг не начинался. Вдоль линии EF наблюдается макроскопический характер области несовершенства, в других направлениях ее размеры составляют несколько периодов.
Если переход от верхних горизонтов к нижним осуществляется поворотом по часовой стрелке, то дислокация правая, а если поворотом против часовой стрелки – левая.
Рис. 9. Механизм образования винтовой дислокации
Винтовая дислокация не связана с какой-либо плоскостью скольжения, она может перемещаться по любой плоскости, проходящей через линию дислокации. Вакансии и дислоцированные атомы к винтовой дислокации не стекают.
В процессе кристаллизации атомы вещества, выпадающие из пара или раствора, легко присоединяются к ступеньке, что приводит к спиральному механизму роста кристалла.
Линии дислокаций не могут обрываться внутри кристалла, они должны либо быть замкнутыми, образуя петлю, либо разветвляться на несколько дислокаций, либо выходить на поверхность кристалла.
Дислокации оказывают влияние на физические свойства кристаллов: механическая прочность, пластичность. Возникновение дислокаций происходит путем накопления в кристалле точечных дефектов. Дислокации могут быть вызваны ростом кристалла, механическим и термическим напряжениями, а также наличием примесей.
Поверхностные дефекты
Поверхностные, или двумерные, дефекты простираются в двух измерениях на расстояния, сравнимые с размером кристалла, а в третьем — составляют несколько параметров решетки. Таковы плоскости двойникования, границы зерен и блоков, стенки доменов, дефекты упаковки и, наконец, сама поверхность кристалла.
У поверхн. дефектов – мала толщина, а длина и ширина больше её на несколько порядков.
Объемные,
или трехмерные,
дефекты — это пустоты, поры, частицы
другой фазы, включения, трещины,
микрокаверны. Размеры
зерен составляют до 1000 мкм. Углы
разориентации составляют до нескольких
десятков градусов (![]() ).
).
Граница между зернами представляет собой тонкую в 5 – 10 атомных диаметров поверхностную зону с максимальным нарушением порядка в расположении атомов.
Процесс деления зерен на фрагменты называется фрагментацией или полигонизацией.
В
свою
очередь
каждый
фрагмент
состоит
из
блоков,
размерами
менее
10 мкм,
разориентированных
на
угол
менее
одного
градуса
(![]() ).
Такую
структуру
называют
блочной
или
мозаичной.
).
Такую
структуру
называют
блочной
или
мозаичной.
