
- •1.Развитие представлений о строении атома.
- •2.Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3. Принципы заполнения орбиталей
- •4. Химическая связь: виды, причины образования, основные характеристики
- •5.Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6.Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь .Ионная связь
- •8. Водородная связь. Межмолекулярные взаимодействия.
- •9.Агрегатные состояния вещества.
- •Газообразное состояние
- •10. Кристаллические вещества. Типы кристаллических решеток. Основные характеристики элементарной кристаллической ячейки. Кристаллические вещества
- •11. Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12.Атомные нарушения структуры кристалла. Классификация дефектов структуры
- •4.1.2. Образование точечных дефектов Причины, вызывающие образование дефектов.
- •4.2. Линейные деффекты (дислокации)
- •13.Термодинамическме системы и параметры. Основные понятия.
- •14.Первое начало термодинамики.
- •15. Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16. Второе начало термодинамики. Энтропия.
- •17. Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18. Обратимые и необратимые химические реакции. Константа химического равновесия.
- •Образование устойчивого (одного или нескольких) в условиях проведения реакции продукта:
- •19. Химическое равновесие. Принцип Ле-Шателье. Химическое равновесие
- •Гетерогенное химическое равновесие
- •20. Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •Например: н2о со льдом; насыщенный раствор с осадком; адсорбционные процессы.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •2. Зависимость скорости реакции от концентрации реагирующих веществ
- •Температурный коэффициент Вант-Гоффа, где
- •Поскольку температура редко изменяется ровно на 10с обычно используют более удобное математическое выражение:
- •2) Образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
- •Образование конечных продуктов и регенерация катализатора:
- •1. Диффузия исходных веществ к поверхности катализатора.
- •6. Отвод продуктов от поверхности катализатора путем диффузии.
- •22. Кинетические уравнения реакций нулевого, первого, второго порядка. Период полураспада.
- •4) Реакции третьего порядка
- •24. Скорость химической реакции в однородной среде. Константа скорости.
- •Скорость гомогенной реакции количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Чтобы выражение для скорости было всегда положительным, необходимо
- •24.Зависимость скорости реакции от температура. Теория активных столкновений и теория активированного комплекса.Зависимость скорости реакции от t см. Билет №21
- •26.Гомогенный и гетерогенный катализ. Смотри билет №21
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •27. Классификация растворов. Основные понятия растворов.
- •28.Механизм образования растворов. Сольваты. Гидраты.
- •29. Растворы. Электролиты и неэлектролиты. Способы выражения состава растворов.Электролиты и неэлектролиты.
- •Способы выражения состава раствора
- •7. Титром – называют число граммов вещества, содержащееся в раствора.
- •Закон эквивалентов
- •30. Гидролиз солей. Константа гидролиза. Рн.
- •46. Электролиз. Потенциал разложения. Поляризация.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •Химическая поляризация возникает при использовании инертных электродов.
- •47. Применение электролиза в технике.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
- •Классификация коррозионных процессов
- •49. Механизмы коррозии.
11. Классификация кристаллов по типу связей. Жидкие кристаллы.
В зависимости от вида химической связи различают следующие типы кристаллических решёток: атомные (ковалентные), ионные, металлические и молекулярные. Чем же будет определятся форма кристаллов соединений с разными связями?
В интересующем нас вопросе играет роль, несомненно, много факторов. Можно считать, что главнейшим из них, определяющим структуру значительной части кристаллов, является плотность упаковки. Как известно, сближение частиц в кристаллах (до известного предела) должно сопровождаться выделением энергии, то есть делать кристаллы более устойчивыми. И если между частицами, составляющим кристалл, действуют лишь ненаправленные связи (ионные или металлические), то указанные предел отвечает наибольшему заполнению объёма, то есть осуществляется принцип наиболее плотной упаковки – из различных возможных кристаллических структур данного вещества наиболее устойчивой будет та, которая в данных рассматриваемых условиях обладает наименьшим запасом энергии.
Но если между частицами, составляющими кристалл, действуют направленные связи (ковалентная связь), то возрастание плотности упаковки повышает устойчивость кристалла лишь до тех пор, пока не начнут существенно изменятся направления валентных связей, так как такие изменения требуют затраты значительного количества энергии.

I. Атомные (ковалентные) кристаллы – построены из атомов, соединённых между собой ковалентными связями. Примером этого типа кристаллов служит алмаз. У него каждый атом углерода связан с четырьмя другими, расположенными в вершинах правильного тетраэдра, который можно отнести к кубической системе (элементарная ячейка представляет собой гранецентрированный куб, в котором ещё дополнительно вписано 4 атома углерода).
Основные характеристики элементарной ячейки алмаза:
а – длина ребра а=0,3456 нм кратчайшее расстояние
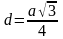 Координационное число к=4 (равно числу
гибридных орбиталей) n=⅛ .
8+½ .
6+4=8; n=8.
Координационное число к=4 (равно числу
гибридных орбиталей) n=⅛ .
8+½ .
6+4=8; n=8.

Расстояние между атомами углерода=0,154 нм
Изолятор SP3 – гибридизация алмаза=3,51г/см3алмаза= 34%
Атомы расположены в соответствии с направлением валентных связей, хотя такие структуры и не отвечают плотной упаковке. ρалм = 34 %. Четыре чередующихся центра остаются незаполненными (незаполненные валентные зоны превращают ковалентные кристаллы в полупроводники или даже в диэлектрики).
По типу алмаза кристаллизируются его аналоги: простые полупроводники: Ge и Si, а также B, SiO2 (кварц), серое олово (α-Sn – устойчивое, ниже 13ºС – серый порошок; явление превращения обычного β-олова в α-олово при низких температурах, известно под названием ''оловянная чума''. Предметы из олова медленно разлагаются в серый порошок, что удаётся предотвратить только введением добавки – Bi. β-олово Sn – белое олово, существует в интервале температур от 13 до 161ºС; серебристо-белый, очень мягкий металл, но твёрже Pb. Существование γ-Sn – свыше 161ºС и до температур плавления, однако новейшими исследованиями не подтверждалось), SiC – карбид кремния; карборунд сложные полупроводники состава АIII,ВV и АII,ВVI, нитриды, сульфиды, арсениды, теллуриды, многие оксиды.
Атомные кристаллы отличаются наличием насыщаемости и направленности ковалентных связей, что приводит к менее плотному расположению частиц у алмаза (ρалм = 34 %). Однако ковалентные кристаллы очень прочны и для разрыва ковалентных связей требуется затрата значительных количеств энергии.
Энергия кристаллической решётки ковалентных – атомных кристаллов составляет от 300-1200 кДж/моль.
Энергия кристаллической решётки – количество энергии, которую необходимо затратить для разрушения кристаллической решётки на составные части и удаления их друг от друга на бесконечное расстояние.
Свойства атомных (ковалентных) кристаллов:
очень высокая твёрдость; высокая температура плавления и кипения, многие из них не способны переходить в жидкое или парообразное состояние, так как они разлагаются при данных высоких температурах; низкая тепло- и электропроводимость (хотя они и увеличиваются с ростом температуры у полупроводников); вещества с такой структурой не растворяются в обычных растворителях.
(В природе углерод встречается в двух кристаллических модификациях: алмаз и графит), карбин – искусственный, черный порошок ρ = 1,9-2 г/см3, гексагональная решетка, построена из прямолинейных цепочек, в которых каждый атом образует 2 и 2 связи, SP3 – гибридизация орбиталей углерода отвечает объединению атомов в цепи вида
– С С С С С– (полиин) или =С=С=С=С= (поликулулен)
Карбин – полупроводник, электропроводность его под влиянием света возрастают.
Алмаз имеет наибольшую твёрдость из всех природных веществ, так как у него очень маленький эффективный радиус, высокой твёрдости также способствует значительное сопротивление углеродных атомов, искажению углов между валентными связями. Этими же сопротивлениями объясняется и то, что укладка атомов в алмазе далека от наиболее плотной (ρалм = 34 %).
Ежегодная мировая добыча алмазов составляет ≈ 5 тонн. Примерно столько же получают искусственно подвергая графит действию высоких температур, свыше 1500ºС (2000ºС) и давлении свыше 6 ГПа (10.1010 Па, 60000 атм.), без доступа воздуха, в присутствии металлических катализаторов (Ni, Fe и так далее).
Применение алмаза: исключительная твёрдость, обуславливает его ценность для техники. Алмаз применят при буровых работах (''алмазное бурение''), резке стека. Наиболее красивые кристаллы шлифуют и под названием бриллиантов употребляют в качестве украшений. Для оценки величины служит карат – единица массы – 0,2 грамма.
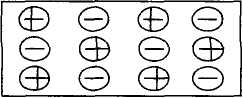
II. Ионные кристаллы – представляют собой совокупность чередующихся ''+'' и '' – '' заряженных ионов, расположенных в узлах кристаллической решётки и связанных между собой ионной связью.
Этот тип решётки могут иметь сложные вещества, состоящие из элементов с сильно отличающимися значениями электроотрицательности. Типичные ионные кристаллы – соли галогенидов щелочных и щелочноземельных металлов, а также многие неорганические соединения: KOH, Na2CO3, KNO3, BeO, KJ и так далее, то есть большинство природных минералов.
Электростатические силы взаимодействия между ионами велики и действуют по всем направлениям (ионная связь характеризуется отсутствием насыщаемости и направле.), то есть каждый ион окружён другими в соответствии с принципом наиболее плотной упаковки.

Координационные числа в таких кристаллах зависят от отношения эффективных радиусов rкатиона/rаниона, так как rк<rа, то отношения лежат в пределах : rк/rа≈ 0,73 1 k=8 (CsCl) ОЦК. rк/rа ≈ 0,41 0,73 k=6 (NaCl) простая кубическая система.
rк/rа ≈ 0,23 0,41 k=4 (ZnS-сфалерит) алмазоподобная система (кубическая).
Так же как и в алмазе, но 4 атома Zn и 4 атома S можно представить как решётку состоящую из двух кубических ГЦК. – подрешёток Zn и S вдвинутых друг в друга на ¼ диагональ куба (k = 3 в ионных кристаллах не реализуется).
Свойства ионных кристаллов:
Большие значения энергии кристаллических решёток. Екр-р ≈ 500 – 1200 кДж/моль, но например кристаллов BeO она достигает значения 4530 кДж/моль.
Ионные кристаллы имеют высокую прочность, но хрупки.
Высоки температуры плавления и кипения. Соединения малолетучи. Например: NaCl Екр-р≈800 кДж/моль, tпл=800ºС, tкип=1465ºС.
Многие ионные кристаллы – диэлектрики (изоляторы), так как в них все электроны делокализованы (низкая температура), то есть принадлежат данному иону. Однако расплавы при высоких температурах хорошо проводят электрический ток.
Хорошо растворяются в полярных растворителях.
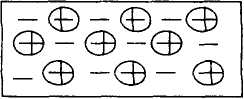
III. Металлические кристаллы представляют собой совокупность чередующихся положительнозаряженных катионов металла, связанных между собой металлической связью – к ним относятся все S-элементы (кроме H и Не), все d-элементы и f-элементы, а также часть p-элементов. И многочисленные сплавы указанных элементов.
Металлическая связь существенно отличается от ионной, ковалентной и межмолекулярной. По своей природе она обусловлена взаимодействием положительных ионов металлов с электронами, переходящими от одного иона к другому. В этом она сближается с ковалентной связью, но в отличие от последней металлическая связь не обладает ни направленностью, ни насыщаемостью, сближаясь в этом с ионной связью.
Благодаря сферическому распределению заряда ионов металла возникает возможность максимальной плотности упаковки их в металлических кристаллах, образуются решетки ГЦК, ГПУ с координационным числом К = 12 (решетка ОЦК с К = 8 объясняется зонной теорией твердых тел).
Свойства металлических кристаллов:
Высокие значения энергии кристаллических решёток Екр.р.100–1000 кДж/моль. Например: Екр.р.W = 842кДж/моль; Екр.р.Na = 109 кДж/моль.
Высокая твёрдость, пластичность (кристаллы с ГЦК- более пластичны), ковкость, тягучесть (Наличие «электронного газа» и сферической симметрии заряда ионов обусловливает и такое важное свойство, как пластичность металлов).
Высокие температуры плавления.(Прочность металлов в большинстве случаев высокая и особенно высока у переходных металлов, что объясняется участием в образовании связи не только s-электронов, но и части электронов d-подуровня. Это сказывается на повышении модуля упругости и температуры плавления. Особенно тугоплавкими являются переходные металлы V,VI,VII А-подгрупп).
Высокая электропроводность, теплопроводность (наличие незанятых энергетических уровней валентных электронов в металлических кристаллах обусловливает их высокую электро- и теплопроводность, высокую отражательную способность световых лучей (металлический блеск).
Металлический блеск, высокая отражательная способность в видимой области спектра.
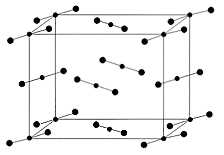
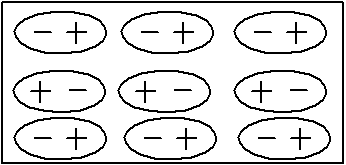
IV. Молекулярные кристаллы – состоят из нейтральных молекул (атомов), соединённых между собой силами межмолекулярного взаимодействия (Ван-дер-Ваальсовыми силами). Следовательно межмолекулярная связь и будет определять структуру и свойства кристаллов. Наиболее простыми по структуре являются атомы инертных газов (хотя решётка образуется в этом случае атомами инертного газа, однако по характеру она относится к молекулярной, а не атомной решётке (инертные газы при кристаллизации образуют чаще всего ГЦК).
Рис. Модель кристаллической решетки йода
Представителями тел с таким типом связи являются Н2, N2, С02, H2O, СН4 в закристаллизованном (твердом) состоянии. Кристаллы этих тел состоят из молекул, между которыми действуют слабые силы Ван-дер-Ваальса природа которых следующая.
Если молекулы вещества являются электрическими диполями (Н2O), то расположением их друг относительно друга так, чтобы плюс одного диполя примыкал к минусу другого, достигается минимум потенциальной энергии. Такой тип взаимодействия называется ориентационным.
Неполярные в обособленном состоянии молекулы некоторых веществ в конденсированном состоянии обладают высокой поляризуемостью (концентрация электронов в атоме перестает обладать сферической симметрией). Поэтому создается возможность удерживания рядом расположенных молекул, как и в первом случае. Такое взаимодействие называется индукционным или поляризационным. Из технических материалов полярная связь между макромолекулами наблюдается в полимерных материалах.
Связь между частицами в макромолекулах в твердом полимере ковалентная. Это вызывает резкое изменение свойств полимерного материала вдоль и поперек направлений макромолекул, что должно учитываться при использовании этих материалов. Представление о полярной связи имеет большое значение для понимания таких явлений, как коррозия металлов, разрушение материала от действия поверхностно-активных веществ и др.
Свойства молекулярных кристаллов:
Низкие значения Екр.р. 60 кДж/моль. Екр.р.(CH4) 10,0 кДж/моль, Екр.р.(H2) 1,0 кДж/моль но в H2O50,2 кДж/моль (из-за водородной связи) HF29,3 кДж/моль
Небольшая твёрдость. Низкие температуры кипения и плавления, поэтому существования некоторых молекулярных кристаллов возможно только при высоком давлении и низких температурах (N2, H2, Cl2, CH4). Температура кипения N2, H2, CH4, O2 – ниже чем комнатная и в обычных условиях это газы. Высокая летучесть.
V. Кристаллы со смешанными связями. Существует большая группа твёрдых веществ, в кристаллах которых одновременно реализуются разные по типу связи, это так называемые переходные и смешанные формы связи. При оценке свойств такого кристаллического тела необходимо вводить поправку на дополнительное специфическое взаимодействие. Например, появления дополнительных видов связи в ковалентных (атомных) кристаллах может привести к резкому изменению основных характеристик. Ярким примером этого служит одна из модификаций углерода – графит.

Графит имеет слоистую структуру и так называемую переходную форму связи между межмолекулярной и ковалентной. Атомы углерода располагаются слоями, в каждом они размещены в вершинах правильного шестиугольника на расстоянии 0,142 нм.
Гексагональная система, т.е. атом углерода в графите не полностью гибридизирован в кристал. решетке ρграфита=2,22г/см3
У каждого атома углерода в плоскости имеется 3 соседних, соединённых между собой ковалентной связью в sp2-гибритизации, и одно облако – р – вытянуто перпендикулярно плоскости слоя и осуществляет -связь с ближайшими тремя соседями. Эти р-электроны перемещаются вдоль слоя при наложении электрического поля, так как - связи делокализованы (этим объясняется его электропроводимость, серый цвет и металлический блеск) однако в направлении перпендикулярном к слоям (основаниям) электропроводность уменьшается, так как между слоями очень большое расстояние (0,335 нм). Следовательно, между слоями могут осуществляться только слабые межмолекулярные силы взаимодействия.

Основные свойства графита: полупроводник, мягкий, легко расслаиваться, химически несколько активнее алмаза. Применение графита: для изготовления стержней для карандашей, электродов, в качестве пигмента, как добавку в антикоррозийные краски; служит замедлителем в ядерных реакторах; (разработано получения алмазов из графита при температуре 2000С и давлении в 53000 МПа или 53000 атм. образуются мелкие кристаллы).
Примерами твердых веществ с переходными формами между металлической и ковалентной связью могут служить такие простые вещества, как (As, Se, Te, Sb, Bi), а также неорганические соли со сложными анионами (CaNO3, CaCO3, NaNO3, CaSO4 и так далее). В них как правило имеется ионная связь между катионами металлов и анионом кислоты, но связь между атомами внутри аниона (CO32-, NO3-, SO42-) бывает преимущественно слабо полярной ковалентной Рис. Модели кристаллических решеток:а – алмаз; б – графит
Жи́дкие криста́ллы (сокращённо ЖК) — вещества, обладающие одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия). По структуре ЖК представляют собой жидкости, похожие на желе, состоящие из молекул вытянутой формы, определённым образом упорядоченных во всем объёме этой жидкости.
Общие сведения о жидких кристаллах.
В конце XIX века были открыты вещества, свойства внутренней структуры которых в жидком состоянии имели черты, характерные как для жидкостей, так и для твердого тела. Такое состояние вещества было названо мезоморфным ("мезос" - промежуточный), что означает состояние с промежуточной структурой, а вещества – жидкими кристаллами. Представлялось, что это название не соответствует истине, что вызвало много споров. Вещество в жидком состоянии обладает текучестью и принимает форму сосуда, в котором находится. Ориентация молекул в жидкости, даже если она имеет место, имеет ближний порядок. Встречаются они довольно часто. Классификация жидких кристаллов
Наряду с термином «жидкие кристаллы» для названия вновь открытого состояния материи на протяжении многих лет употреблялись и другие термины: текучие кристаллы, мезоморфное состояние либо паракристаллы. Однако чаще наряду с термином жидкий кристалл применяется название анизотропная жидкость, а чтобы более детально подчеркнуть тип жидкого кристалла, употребляют следующие термины: нематическая, смектическая или

холестерическая жидкости. Жидкие кристаллы, входящие в каждую из групп, различаются физическими, и , прежде всего, оптическими свойствами. Это отличие следует из их структурного различия.
Смектические ( от греч. "смегма" - мыло) жидкие кристаллы могут быть образованы веществами, молекулы которых имеют вытянутую сигарообразную форму, причем они ориентированы

параллельно друг другу и образуют тонкий слой. Внутри слоев, в боковых направлениях, строгая периодичность в расположении молекул отсутствует. Смектическими жидкими кристаллами являются, например, радужные мыльные пузыри. Смектический слой обладает важнейшим свойством твердого кристалла - анизотропией оптических свойств, так как вдоль длинной оси молекул свет распространяется с меньшей скоростью, чем поперек нее, и показатели

преломления в жидком кристалле в этих направлениях различны.
Второй тип жидкокристаллических веществ называется нематическим (от греч. "нема" - "нить"). Эти вещества содержат нитевидные частицы, которые либо прилипают к стенкам сосуда, либо остаются свободными. Эти нити выглядят "причесанными" и направлены параллельно друг другу, но могут скользить вверх и вниз. Подходящая аналогия для нематических жидких кристаллов - длинная коробка с короткими карандашами, которые могут свободно поворачиваться вокруг своей оси, перемещаться вдоль коробки, но никогда не встают поперек. Нематические жидкие кристаллы не такие упорядоченные, как смектические. Тем не менее они тоже оптически анизотропны и под микроскопом дают "муаровую" текстуру с чередующимися светлыми и темными полосами. Частицы нематического жидкого кристалла реагируют на электрическое и магнитное поле так же, как железные опилки, располагаясь самым упорядоченным образом вдоль силовых линий поля.
Холестерические жидкие кристаллы - это в основном производные холестерина. Здесь плоские и длинные молекулы собраны в слои (как у смектических), но внутри каждого слоя расположение частиц похоже больше на нематические жидкие кристаллы. Интересно то, что тончайшие соседние молекулярные слои в холестерическом жидком кристалле немного повернуты друг относительно друга, благодаря чему стопка подобных слоев описывает в пространстве спираль. В силу столь своеобразного строения эти жидкие кристаллы обладают необычными оптическими свойствами. Обычные свет, проходя через такие вещества, распадается на два луча, которые преломляются по-разному. Когда бесцветный, как вода, холестерический жидкий кристалл попадает в зону с меняющейся температурой, он принимает яркую окраску.
Свойства ЖК: отсутствие кристаллической решётки, наличие только ближнего порядка (неустойчивое состояние). Под действием механических перегрузок или изменений температуры тела могут закристаллизоваться. Текучесть. Изотропны. Нет фиксированной температуры плавления.
