
- •1.Развитие представлений о развитии атома
- •2. Квантовые числа и двойственная природа электрона
- •3.Принцип заполнения электронных орбиталей в многоэлектронных атомах.
- •Очередность заполнения орбиталей:
- •4. Химическая связь: виды, причины, основные характеристики.
- •5.Ковалентная химическая связь. Метод валентных связей. Свойства ковалентной связи
- •Ковалентная связь. Метод молекулярных орбиталей. Свойства ковалентной связи
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь.
- •8.Водородная связь. Межмолекулярные взаимодействия
- •9.Агрегатное состояние вещества
- •12.Атомные нарушения структуры кристаллов
- •14.Первое начало термодинамики
- •17.Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •19.Химическое равновесие. Принцип Ле-Шателье.
- •20.Химическая кинетика. Основные понятия химической кинетики. Закон действующих масс. Молекурярность и порядок реакции
- •21.Факторы влияющие на скорость хим реакции.
- •22.Кинетические уравнения реакции первого второго и третьего порядка. Период полураспада.
- •23.Зависимость скорости химической реакции от температуры. Уравнение Аррениуса. Энергия активации
- •24.Скорость химической реакции в однородной среде. Константа скорости.
- •25.Каталитические процессы
- •Степень гидролиза
- •Вывод значения pH
- •Первый закон Рауля
- •Второй закон Рауля
- •Понижение температуры кристаллизации растворов
- •Повышение температуры кипения растворов
- •Криоскопическая и эбулиоскопическая константы
- •Растворы электролитов
- •Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении Диссоциация в растворах
- •Диссоциация при плавлении
- •Классическая теория электролитической диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды
- •Известные способы диссоциации воды:
- •Вывод уравнения Нернста
- •Устройство
- •Классификация электрохимических цепей.
19.Химическое равновесие. Принцип Ле-Шателье.
Принцип Ле-Шателье
Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема.
Повышение температуры смещает равновесие в сторону эндотермической реакции.
Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещают равновесие в сторону прямой реакции.
Катализаторы не влияют на положение равновесия.
20.Химическая кинетика. Основные понятия химической кинетики. Закон действующих масс. Молекурярность и порядок реакции
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение помножается на −1.
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Порядок химической реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка
График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
К![]() инетическое
уравнение имеет следующий вид:
инетическое
уравнение имеет следующий вид:
Реакция первого порядка
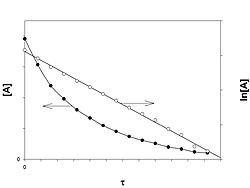
![]()
График зависимости концентрации реагента A для первого порядка реакции
Кинетическое уравнение реакции первого порядка:
![]()
Приведение уравнения к линейному виду даёт уравнение:
![]()
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
![]()
Период полупревращения:
![]()
Реакция второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]()
или
![]()
В первом случае скорость реакции определяется уравнением
![]()
Линейная форма уравнения:
![]()
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
![]()
![]()
Во втором случае выражение для константы скорости реакции будет выглядеть так:
![]()
Молекулярность Реакции:
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
